Іприт
Іпри́т, біс(2-хло́роети́л)сульфі́д — сульфуроорганічна сполука складу (ClCH2CH2)2S, один з представників ряду іпритів. Іприт вперше був отриманий німецьким хіміком Віктором Меєром в 1886 році. Цьому передували роботи хіміків Деспре (1822), Німана (1859), Гутмана (1860), які досліджували даний клас сполук, проте не виділили її в чистому вигляді.
| Іприт | |
|---|---|
 | |
| Назва за IUPAC | біс(2-хлороетил)сульфід |
| Інші назви | 2,2'-дихлородіетиловий тіоетер, гірчичний газ |
| Ідентифікатори | |
| Номер CAS | 505-60-2 |
| Номер EINECS | 684-527-7 |
| KEGG | C19164 |
| Назва MeSH | D02.455.526.728.468 |
| ChEBI | 25434 |
| RTECS | WQ0900000 |
| SMILES |
C(CCl)SCCCl[1] |
| InChI |
InChI=1S/C4H8Cl2S/c5-1-3-7-4-2-6/h1-4H2 |
| Номер Бельштейна | 1733595 |
| Номер Гмеліна | 324535 |
| Властивості | |
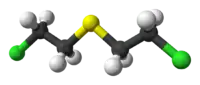
| Молекулярна формула | C4H8Cl2S, (ClCH2CH2)2S |
| Молярна маса | 159,078 г/моль |
| Густина | 1,2741 г/см³[2] |
| Тпл | 14,45 °C |
| Ткип | 216 °C |
| Розчинність (вода) | менше 1% |
| Показник заломлення (nD) | 1,5313[2] |
| Небезпеки | |
| ЛД50 | 100 мг/кг (шкіра) 1000-1500 мг-хв/кг (респіраторно) 10000 мг/кг (через шкіру) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Чистий іприт є безбарвною маслянистою речовиною без запаху (технічний іприт має часниково-гірчичний запах і жовто-коричневий колір). Погано розчиняється у воді і необмежено — у багатьох органічних розчинниках.

У часи Першої світової війни іприт застосовувався як бойова отруйна речовина шкірно-наривної дії. Міжнародне позначення іприту як хімічної зброї — HD. Боєприпаси з іпритом у Німеччині позначалися жовтим хрестом (він входить до складу бойової суміші жовтий хрест, нім. Gelbkreuz), у США кодуються двома зеленими кільцями.
У 1993 році, в результаті підписання Конвенції про хімічну зброю, використання іприту як хімічної зброї було заборонено. Його включили до списку 1, котрий регламентує виробництво та обіг небезпечних речовин.[3]
Термін іприт походить від назви бельгійського міста Іпр, поблизу якого у ніч проти 13 липня 1917 року німецькими військами було вперше застосовано дану речовину як хімічну зброю.
Токсична дія іприту полягає в ушкодженні очей, шкіри, дихальних шляхів. Симптоми отруєння проявляються із прихованим періодом у дві години, але за спекотної погоди і вологої шкіри вони з'являються одразу. Наслідком контакту з речовиною є поява пухирців із жовтуватою рідиною, які довго загоюються і залишають рубці. При концентрації іприту у повітрі 0,03 мг/л смерть настає протягом 2—5 хвилин.
Речовина швидко проникає у будівельні матеріали, поглинається текстилем, гумою, папером, тому отруєння можливе і при контакті з зараженими предметами.
Фізичні властивості
Чистий іприт є безбарвною маслянистою рідиною зі слабким запахом касторки, технічний продукт має колір від жовтого до темно-коричневого і різкий запах (часнику або гірчиці). Густина парів по повітрю складає 3,5. Тиск пари при 20 °С — 0,072 мм рт. ст.
Температура плавлення чистої речовини складає 14,5 °C, а в технічного іприту, внаслідок наявності домішок, вона дещо нижча. Для запобігання замерзанню під час Першої світової війни в нього додавали хлоропікрин, хлоробензен, тетрахлорометан.
Погано розчиняється у воді (менше 1%), необмежено розчиняється в оліях, жирах, бензині, гасі, ацетоні, тетрахлорометані, спиртах, хлоропікрині. Змішується з іншими отруйними речовинами: етилдихлороарсином, фенілдихлороарсином, люїзитом.
Леткість іприту: 75 мг/м³ при 0 °C (твердий), 610 мг/м³ при 20 °C (рідкий), 2860 мг/м³ при 40 °C (рідкий).
Не спричиняє корозії при зберіганні його в алюмінієвих контейнерах; латунь швидко кородує при температурі 65 °C. У вологому повітрі технічний іприт із домішками, які утворюються внаслідок його розкладання (сірководень, хлороводень, етилен), спричиняє корозію сталі.
Отримання
Існує три основних способи синтезу іприту: з оксирану (оксиду етилену), етилену та вінілхлориду.
Синтез із оксирану проводиться за температури 80 °C в дві стадії: сульфуванням за допомогою сірководню або гідросульфідів для отримання тіодигліколю, а згодом — хлоруванням сполуки:
Після вакуумної дистиляції отримують іприт з чистотою 95%. Вихід синтезу складає 90%. Цей спосіб вперше був проведений німецьким хіміком В. Меєром у 1886 році.
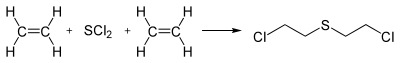
Синтез іприту з етилену і хлоридів сірки розроблявся за часів Першої світової війни, а також після її закінчення. Переважним способом отримання є реакція з SCl2:
Хлорид сірки(II) зазвичай має домішки дихлорополісульфідів (S2Cl2, S3Cl2, S5Cl2), тому кінцевий продукт може бути забруднений хлороетилполісульфідами (ClCH2CH2)2Sx. Наявний у реакційній суміші вільний хлор може утворювати поліхлоровані домішки.
Отримання іприту з вінілхлориду є найбільш доцільним з огляду на легкість протікання реакції — вона відбувається вже за кімнатної температури (15—25 °C):
Як ініціатори реакції використовують органічні пероксиди та ультрафіолетове випромінювання. Реакція відбувається протягом 10 хвилин із виходом продукту близько 75%. При використанні замість сірководню 1-меркапто-2-хлороетану HSCH2CH2Cl вихід реакції наближується до 100%.
Хімічні властивості
Іприт повільно гідролізується із утворенням хлоридної кислоти і тіодигліколю:
Він слабко розчиняється у воді, тому може не зазнавати гідролізу тривалий час. Процес гідролізу прискорюють підвищення температури і присутність лугів.
Однією з найважливіших реакції є дія уротропіну під час гідролізу: продуктом взаємодії утворюваної хлоридної кислоти з уротропіном є формальдегід, який сприяє загоєнню ран:
При дії сильних окисників (перманганату калію, хроматної кислоти, нітратної кислоти, гіпохлоритів), сульфід окиснюється до сульфоксиду, а згодом — до сульфону:
Попри те, що продукти окиснення також є отруйними речовинами, цей спосіб застосовується для дегазації, тому як вони є кристалічними речовинами і не чинять впливу на шкіру.
Подібно до інших тіоетерів, іприт здатен утворювати з солями металів сульфонієві сполуки. Утворювані комплекси мають характерне забарвлення, а іноді і низьку розчинність, тому інколи застосовуються в аналітичній хімії. Частіше реакція проводиться із галогенідами важких металів: йодидами і хлоридами купруму, цинку, титану, платини, ауруму:
Токсичність

Іприт діє на організм людини як інгаляційна і контактна отрута: краплі та аерозолі іприту вражають дихальні шляхи, шкіру, очі.
Речовина здатна проникати до організму крізь шкіру. Ця здатність залежить від температури довкілля: при 21—23 °C проникання складає 1,4·10−3 мг/(см²·хв), при вищих — близько 2,7·10−3 мг/(см²·хв). Проникнення в організм іприту у кількості 6·10−3 у половині випадків спричиняє появу пухирів. Утворення невеликих еритем відбувається при дозі 0,01 мг/см² шкіри, великих — при дозі понад 0,5 мг/см². Очі уражаються навіть іпритом невеликої концентрації: його дія при концентрації 1,2·10−3 мг/л протягом 45 хвилин спричиняє запалення очей, спазми повік, світлобоязнь, які тривають до 4 тижнів.
Дія іприту концентрація 0,03 мг/л протягом 2—5 хвилин є летальною. Концентрація 0,01 мг/л є небезпечною протягом 15 хвилин і веде до сильних ушкоджень очей, шкіри.
Контакт іприту зі шкірою спершу не викликає ніяких неприємних відчуттів. Протягом перших 2—5 хвилин він проникає крізь шкіру, далі розчиняється у підшкірному жирі і згодом, через 20—30 хвилин, повністю всмоктується і потрапляє в кров. Після всмоктування настає прихований період тривалістю від 2 годин до доби залежно від дози, температури і вологості повітря, структури і вологості шкіри. У спекотну погоду, в разі гарячої, вологої шкіри або ніжних її ділянок період прихованої дії значно скорочується і може бути майже відсутнім.
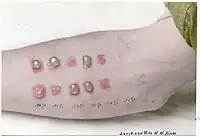
Перші ознаки ураження після закінчення періоду прихованого дії проявляються у вигляді свербіння, печіння і почервоніння шкіри (еритеми) у місцях контакту з рідким або газоподібним іпритом. Шкіра натягується, стає сухою і теплою. При невеликих дозах ці явища через кілька діб проходять. При більш високих дозах розвивається набряклість, по краях якої через 16—30 годин після контакту з отрутою з'являється безліч дрібних пухирців. Надалі вони зливаються в більші або один великий пухир з безбарвною або жовтуватою рідиною. Бульбашки прориваються і на шкірі утворюються хворобливі іпритні виразки, загоєння яких може тривати понад 2 місяці. Вторинна інфекція може призвести до гнійних запалень уражених ділянок шкіри. На їх місці залишаються рубці.
Захист
Основним захистом від іприту, зокрема, очей, обличчя та дихальних шляхів, є протигаз. Після потрапляння на бавовняний одяг іприт за три години повністю просочує його, що може в подальшому спричинити додаткові ураження. Для запобігання потраплянню сполуки на одяг та під нього, користуються спеціальними захисними костюмами.
Для обробки шкіри (усунення незначних крапель іприту), одягу або предметів, що контактували з іпритом, застосовують окисники та агенти хлорування (гіпохлорити, хлорне вапно, хлороаміди).
Див. також
- Азотні іприти
- Кисневий іприт
- Сесквііприт
Примітки
- Mustard gas
- При температурі 20 °C.
- Schedule 1. opcw.org. Organization for the Prohibition of Chemical Weapons. Процитовано 15 червня 2015. (англ.)
Джерела
- Hoenig S. L. Compendium of Chemical Warfare Agents. — New York : Springer, 2007. — 222 p. — ISBN 0-387-34626-0. (англ.)
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Александров В., Емельянов В. Отравляющие вещества. — 2-е изд, переработанное и доп. — М. : Военное издательство, 1990. — 272 с. — ISBN 5-203-00341-6. (рос.)
- Франке З. Химия отравляющих веществ. — М. : Химия, 1973. — Т. 1. — 440 с. (рос.)