Вінілхлорид
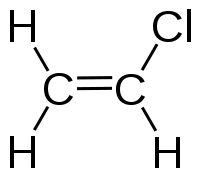
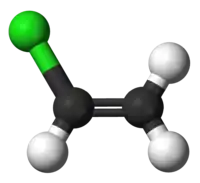
Віні́лхлори́д (хло́роете́н, хлорвіні́л) CH2=CHCl — органічна сполука, безбарвний газ, хлоропохідна етилену.
| Вінілхлорид | |
|---|---|
 | |
 | |
| Назва за IUPAC | хлоретен |
| Інші назви | хлоретилен, монохлоретен, монохлоретилен, етилен монохлорид |
| Ідентифікатори | |
| Номер CAS | 79-11-8 |
| Номер EINECS | 200-831-0 |
| Номер EC | 200-831-0 |
| KEGG | C06793 |
| Назва MeSH | D02.455.326.271.884.750 і D02.455.526.439.975 |
| ChEBI | 28509 |
| RTECS | KU9625000 |
| SMILES |
C=CCl |
| InChI |
1S/C2H3Cl/c1-2-3/h2H,1H2 |
| Номер Бельштейна | 1731576 |
| Номер Гмеліна | 100541 |
| Властивості | |
| Молярна маса | 61,992328 г/моль |
| Молекулярна маса | 62,5 а.о.м. |
| Зовнішній вигляд | безбарвний газ |
| Запах | ефірний |
| Густина | 0,9106 г/см3 (20°C) |
| Тпл | -154°C |
| Ткип | -13°C |
| Розчинність (вода) | 1,1 г/л |
| Розчинність (діетиловий ефір) | добре розчинний |
| Тиск насиченої пари | 0,13 кПа (-105,6°С) |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-37,26 кДж/моль |
| Ст. ентальпія згоряння ΔcH |
-1198,1 кДж/моль |
| Ст. ентропія S |
263,98 Дж/(моль*К) |
| Теплоємність, c |
53,7 Дж/(моль*К) |
| Небезпеки | |
| ЛД50 | 500 мг/кг (орально, щури) |
| ГГС піктограми | 
|
| ГГС формулювання небезпек | H220, H350 |
| ГГС запобіжних заходів | P201, P202, P210, P281, P308+P313, P377, P381, P403
, P405, P501 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Отримання
Вінілхлорид можна отримати приєднанням хлороводню до ацетилену:
Його також одержують шляхом термічного дегідрогалогенування дихлоретану Cl-CH2-CH2Cl при темпаратурі близько 500 °С в присутності активованого вугілля як каталізатора:
Хімічні властивості
У молекулі вінілхлориду неподілені пари електронв хлору зміщуються до π-зв'язку, тобто хлор проявляє +M-ефект, внаслідок чого два атома карбону разом набувають частково негативного заряду. Але внаслідок велокої електронегативності хлору він проявляє -I-ефект та атом карбону, який знахоться біля нього набуває часткового позитивного заряду (а другий атом карбону — негативного). В результаті кратність зв'язку C-Cl збільшується, він стає коротшим і міцнішим та реакційна здатність у реакціях нуклеофільного заміщення зменшується.
В присутності хлориду заліза або алюмінію приєднує хлороводень. Реакція йде за правилом Марковникова:
Спочатко утворюється карбокатіон , до якого приєднується аніон хлору.
За звичайних умов вінілхлорид не вступає у реакції з багатьма нуклеофілами, але вступає у реакцію Вільямсона (яка також є реаекцією нуклеофільного заміщення). Це пов'язано з тим, що в присутності сильних основ (алкоголятів) відбувається дегідрогалогенування, а потім до ацетилену приєднується спирт:
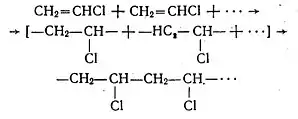
В присутності органічних пероксидних сполук при 40 °С і тиску 5 атм вінілхлорид легко полімеризується в еластичну масу — полівінілхлорид (поліхлорвінілову смолу):
Джерела
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.