Етилдихлороарсин
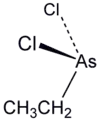
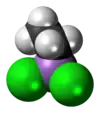
Ети́лдихло́роарси́н — арсенорганічна сполука складу C2H5AsCl2. Має токсичну дію на шкіру та органи дихання. У період Першої світової війни застосовувалася збройними силами Третього Рейху як отруйна речовина шкірно-наривної, а також задушливої дії. У контексті військового застосування має позначення ED.
| Етилдихлороарсин | |
|---|---|
 |
 |
| Інші назви | ED, DICK |
| Ідентифікатори | |
| Номер CAS | 598-14-1 |
| Номер EINECS | 209-919-3 |
| SMILES |
CC[As](Cl)Cl[1] |
| InChI |
InChI=1S/C2H5AsCl2/c1-2-3(4)5/h2H2,1H3 |
| Властивості | |
| Молекулярна формула | C2H5AsCl2 |
| Молярна маса | 174,889 г/моль |
| Густина | 1,6595 г/см³ |
| Тпл | -65 °C |
| Ткип | 155,3 °C |
| Розчинність (вода) | <1 г/л |
| Тиск насиченої пари | 2,29 мм рт. ст. (21,5 °C) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
Вперше етилдихлороарсин отримав у 1881 році В. Ла Кост[2]. Ще до початку Першої світової війни стосовно нього, а також алкільних аналогів — метил- і фенілдихлороарсину, вже проводилися токсикологічні дослідження.
У бойових діях етилдихлороарсин вперше був застосований в артилерійських снарядах навесні 1918 року німецькою стороною, під кодовою назвою DICK. Він використовувався як окрема бойова отрута, так і у поєднанні з іншими агентами. Зокрема, спочатку він класифікувався як складова зброї типу «зелений хрест 3», а згодом — як «жовтий хрест 1». Так, відомими сумішами із його використанням є:
- дихлорометиловий етер (18 %), етилдихлороарсин (37 %), етилдибромоарсин (45 %);
- дихлорометиловий етер (20 %), етилдихлороарсин (80 %).
Фізичні властивості
Етилдихлороарсин — це безбарвна рухлива рідина, що має гострий, а у малих концентраціях фруктовий запах. Він добре розчиняється в органічних розчинниках: бензені, ацетоні, циклогексані, діетиловому етері. Розчиняючись у воді, зазнає гідролізу.
Леткість етилдихлороарсину — 6,5 мг/м³ при 0 °C; 20,0 мг/м³ при 20 °C; 27,200 мг/м³ при 25 °C.
Отримання
Історичні методи
Вперше етилдихлороарсин був синтезований за реакцією між діетилртуттю та трихлороарсином:
У 1908 році був запропонований метод отримання при нагріванні у закритій ємності етиларсину і хлорувальних агентів на кшталт HgCl2, SnCl2 чи SbCl3:
Лабораторний метод
Отримання у лабораторних умовах можливе шляхом реакції Маєра, взаємодією етилйодиду із арсенітом натрію, синтезованим in situ. Для цього в колбу місткістю близько 2 л вносять розчин гідроксиду натрію (60 г NaOH та 500 мл води), розчиняють 50 г оксиду As2O3, додають 100 г етилйодиду і підключають мішалку. Взаємодію проводять на водяній бані протягом 2 годин, поступово підвищуючи температуру до точки кипіння.
Отриманий розчин переносять у перегінну колбу та відділяють побічні продукти (етер і спирт), а також надлишкову кількість етилйодиду. Залишок у колбі обережно нейтралізують концентрованою сульфатною кислотою, після чого додають 90 г метилсульфату і на водяній бані відганяють метилйодид[3]. Після додавання півлітра концентрованої хлоридної кислоти суміш швидко фільтрують і пропускають крізь фільтрат струмінь газуватого діоксиду сірки:
Розчин набуває прозорості, а на дні збирається оліїста фракція етилдихлороарсину, котру відділяють ділильною воронкою і просушують над хлоридом кальцію, а згодом переганяють вакуум-дистиляцією. Вихід продукту становить 75—80 %
Промислові методи
Більшість способів отримання етилдихлороарсину у промислових масштабах базуються на реакції між арсенітом натрію та етилйодидом. Також у період Другої світової війни був розроблений промисловий синтез, заснований на взаємодії тетраетилсвинцю і трихлороарсину:
Хімічні властивості
За своїми хімічними властивостями етилдихлороарсин аналогічний до метил- і фенілдихлороарсинів. У воді етилдихлороарсин гідролізується до етилзаміщеного арсиноксиду — оліїстої рідини із часниковим запахом, але без токсичної дії на шкіру:
Він окиснюється в етиларсенатну кислоту під дією пероксиду водню та нітратної кислоти:
Атоми Хлору у молекулі можуть бути заміщені слабшим галогеном (у розчині ацетону):
При дії сірководню утворюється етилсульфід:
Аналогічно до багатьох інших бойових отруйних речовин, етилдихлороарсин є нестійким до дії гіпохлоритів і розкладається при дії на нього як їхніх розчинів, так і суспензій.
Токсичність
Етилдихлороарсин має подразнюючу дію на дихальні шляхи. При його вдиханні він діє як отруйна речовина задушливої дії та спричинює бронхопневмонію та набряк легень. Ураження відбувається при його концентрації у повітрі більше 0,05 мг/л (при 15-хвилинній дії), концентрація вище 0,2 мг/л може бути смертельною.
Шкірна дія етилдихлороарсину проявляється не так сильно, як у близькоспорідненого до нього люїзиту. Утворення пухирців на уражених ділянках шкіри відбувається без прихованого періоду. Порогова концентрація, при якій має місце подразнення шкіри, становить 0,1—0,5 мг/см², а утворення пухирців — 2 мг/см².
Примітки
- ETHYLDICHLOROARSINE
- La Coste. // Annalen der Chemie und Pharmazie. — 1881. — Т. 208, вип. 33 (3 листопада). (нім.)
- Оскільки наступні реакції протікають у кислому середовищі, присутня у значній кількості йодидна кислота може утворювати дийодоарсин. Для запобігання цьому йодид-іони відганяються у формі метилйодиду.
Джерела
- Hoenig, S. L. Compendium of Chemical Warfare Agents. — New York : Springer, 2007. — 222 p. — ISBN 0-387-34626-0. (англ.)
- Sartori, M. The War Gases. — New York : Van Nostrand, 1939. — 360 p. (англ.)
- Франке З. Химия отравляющих веществ. — М. : Химия, 1973. — Т. 1. — 440 с. (рос.)