Хлорид заліза(III)
Ферум(ІІІ) хлорид — неорганічна сполука з формулою FeCl3. Сполука є сіллю слабкого ферум(ІІІ) гідроксиду і сильної хлоридної кислоти. Речовина сильно гігроскопічна і здатна утворювати кристалогідрати FeCl3·nH2O (де n = 4, 5, 6, 7, 12), з яких найпоширенішим є гексагідрат[джерело?]. У неполярних розчинниках, у рідкому та газоподібному станах хлорид існує у вигляді димеру Fe2Cl6.
| Хлорид заліза(III) | |
|---|---|
_chloride_hexahydrate.jpg.webp) | |
 | |
| Інші назви | Трихлорид заліза Ferrum chloratum Ferri(III) chloridum |
| Ідентифікатори | |
| Номер CAS | 7705-08-0 |
| Номер EINECS | 231-729-4 |
| DrugBank | 15536 |
| ChEBI | 30808 |
| RTECS | LJ9100000 |
| SMILES |
Cl[Fe](Cl)Cl[1] |
| InChI |
InChI=1S/3ClH.Fe/h3*1H;/q;;;+3/p-3 |
| Номер Гмеліна | 1903 |
| Властивості | |
| Молекулярна формула | FeCl3 |
| Зовнішній вигляд | жовтий (безводний), жовто-червоний (гексагідрат) |
| Густина | 2,898 г/см³ |
| Тпл | 308 °C |
| Ткип | 317 °C |
| Розчинність (вода) | 92 г на 100 г (20 °C) |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
–502,1 кДж/моль |
| Ст. ентропія S |
142,3 Дж·моль–1·К–1 |
| Теплоємність, c |
94,84 Дж·моль–1·К–1 |
| Пов'язані речовини | |
| Інші аніони | оксид заліза(III), гідроксид заліза(III) |
| Інші катіони | хлорид заліза(II) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Розчиняється в SO2, AsCl3, PBr3, CS2. Проявляє властивості окисника. Сполука сильно гігроскопічна, для неї відомі кристалогідрати FeCl3·4Н2О, FeCl3·5Н2О, FeCl3·6Н2О, FeCl3·7Н2О, FeCl3·12Н2О. При збільшенні вмісту кристалізаційної води, колір кристалогідратів змінюється від червоного до лимонно-жовтого та знижується їхня температура плавлення.
Молярна електропровідність при нескінченному розведенні при 25 °C дорівнює 433,05 См·см²/моль. Сіль (як утворена слабкою основою і сильною кислотою) має кислу реакцію, у водному розчині сильно гідролізована (продуктами є основні хлориди та гідроксокомплекси).
Отримання
Ферум(III) хлорид отримують взаємодією хлору із залізом або його дією на Fe2O3 з вугіллям (за підвищених температур хлорид існує у формі димеру):
Сполука також утворюється при пропусканні хлору крізь розплав FeCl2 або його дії на пірит:
Також FeCl3 можна синтезувати дією агентів хлорування на ферум(III) оксид:
Хімічні властивості
Ферум(ІІІ) хлорид гідролізується у водному розчині з утворенням ферум(III) гідроксиду:
При сильному нагріванні сполука розкладається до хлориду FeCl2, а також окиснюється:
FeCl3 взаємодіє з кислотами, а також реагує із лугами з утворенням гідратів оксиду (або спрощено гідроксиду Fe(OH)3):
Ферум(ІІІ) хлорид є окисником по відношенню до багатьох галогенідів та сполук сульфуру:
FeCl3 взаємодіє з тіоціанатами з утворенням комплексу із характерним «кривавим» забарвленням — ця реакція є якісною у виявленні тіоціанатів:
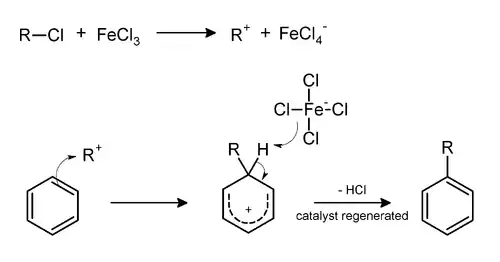
Реакція Фріделя — Крафтса
Ферум(ІІІ) хлорид у суміші з алюміній хлоридом виступає каталізатором у процесі алкілювання ароматичних сполук.
Аналітична якісна реакція на таніни
Ферум(ІІІ) хлорид (рідко) використовується для якісного визначання танінів в чаї, фруктах, рослинах. При взаємодії ферум(ІІІ) хлориду і танінів в осаді буде зелено-чорний органічний барвник. Цю якісну реакцію відкрив і вивчав хімік Роберт Бойль.
Токсичність
Ферум(III) хлорид проявляє токсичні властивості, є висококорозійним та кислотним агентом.
Застосування
Використовується у дуже багатьох галузях:
- для очищення стічних вод від фосфатів шляхом їх осадження, також як коагулянт;
- для травлення (наприклад, на фотогравюрах, при створенні друкованих плат);
- у текстильному виробництві як протрава при фарбуванні тканин;
- в медицині: як частина комплексного лікування анемії;
- в хімічній лабораторії:
- в безводній формі як осушувач реагентів в певних реакціях;
- реагент для виявлення SCN–, Sn2+, H2O2, фенолів та енолів;
- як каталізатор у реакції Фріделя — Крафтса;
- разом з NaI в ацетонітрилі для м'якого відновлення органічних азидів до первинних амінів.
Див. також
Примітки
- Iron trichloride
Джерела
- Реми Г. Курс неорганической химии / Под ред. А. В. Новоселовой. — М. : ИИЛ, 1966. — Т. 2. — 833 с. (рос.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / Под ред. В. И. Спицына. — М. : «Мир», 1972. — Т. 2. — 871 с. (рос.)
- Справочник химика / Никольский Б. П., 1971, 1168 с.(рос.)
- Энциклопедический словарь Брокгауза и Ефрона, 1890—1907. (рос.)
- Железа хлориды // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Сов. энцикл., 1990. — Т. 2 : Даффа реакция — Меди сульфат. — Стб. 267. — Библиогр. в конце ст. — ISBN 5-85270-035-5.(рос.)