Гіпофосфітна кислота
Гі́пофосфі́тна кислота́, фосфіна́тна кислота́[2] — неорганічна сполука, одноосновна кислота складу H3PO2. Проявляє відносно сильні кислотні властивості та утворює з основами ряд солей гіпофосфітів. Здатна також утворювати фосфороорганічні сполуки — фосфінати.
| Гіпофосфітна кислота | |
|---|---|
 |
 |
| Інші назви | фосфінатна кислота, фосфінова кислота фосфорноватиста кислота |
| Ідентифікатори | |
| Номер CAS | 6303-21-5 |
| Номер EINECS | 228-601-5 |
| KEGG | C05339 |
| ChEBI | 29031 |
| SMILES |
O[PH2]=O[1] |
| InChI |
InChI=1S/H3O2P/c1-3-2/h3H2,(H,1,2) |
| Номер Гмеліна | 25147 |
| Властивості | |
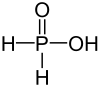
| Молекулярна формула | H3PO2 |
| Молярна маса | 65,997 г/моль |
| Зовнішній вигляд | безбарвні кристали або масляниста рідина |
| Густина | 1,49 г/см³ |
| Тпл | 26,5 °C |
| Ткип | 130 °C (розкл.) |
| Кислотність (pKa) | 1,2 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-608,8 кДж/моль (тверда) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Гіпофосфітна кислота застосовується як сильний відновник, а також як стабілізатор у виробництві поліамідів, полівінілхлориду, поліуретанів.
Структура
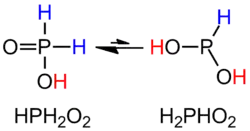
Згідно будови молекули, сполука H3PO2 є одноосновною кислотою, тому для позначення кількості «кислотних» атомів гідрогену формулу інколи записують як HOP(O)H2 або, рідше, H(H2PO2).
У молекулі кислоти може відбуватися явище таутомерії — вона ізомеризується до дигідроксиду фосфору.
Отримання
Промисловий спосіб отримання гіпофосфітної кислоти включає взаємодію білого фосфору та розчину гідроксиду кальцію, доведеного до кипіння.[3] Утворені продукти в подальшому оброблюються сульфатною кислотою з утворенням малорозчинного сульфату кальцію:
Очищений від осаду розчин концентрують за зниженого тиску. У продаж надходять розчини із концентраціями 50%, 30—32% та 10%.
Менш поширеним методом отримання кислоти є окиснення фосфіну йодом у водному розчині:
Для отримання чистої, безводної кислоти, сполуку екстрагують з водного розчину у діетиловий етер, з якого виділяють у формі безбарвних легкоплавких кристалів.
Хімічні властивості
При нагріванні понад 130 °C фосфітна кислота диспропорціонує із утворенням ортофосфатної кислоти і фосфіну:
У водному розчині гіпофосфітна кислота дисоціює як одноосновна кислота:
- ; pKa=1,2
Взаємодіє із лугами та гідроксидами, утворюючи ряд гіпофосфітів:
Концентровані розчини кислоти проявляють сильні відновні властивості. В окисно-відновних реакціях окиснюється зазвичай до фосфітної кислоти:
Відновлюється активним воднем (в момент його виділення в результаті взаємодії металу та кислоти) до фосфіну:
Застосування
Гіпофосфітна кислота застосовується як ефективний відновник (наприклад, при нікелюванні металів), а також стабілізатора у виробництві поліамідів, полівінілхлориду, поліуретанів.
Примітки
- Hypophosphorous acid-d3 solution
- Термін фосфінатна кислота (фосфінова) застосовується в органічній хімії для позначення сполуки як прекурсору фосфінатів.
- У реакції може застосовуватися також гідроксид барію, проте він значно дорожчий за гідроксид кальцію.
Джерела
- Greenwood N. N., Earnshaw A. Chemistry of the Elements. — 2nd. — Oxford : Butterworth-Heinemann, 1997. — P. 513-514. — ISBN 0-7506-3365-4. (англ.)
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Fee D. C., Gard D. R., Yang C. Phosphorus Compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 18. — P. 375. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Bettermann G. Phosphorus Compounds, Inorganic // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 5. — DOI: (англ.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)