Фосфітна кислота
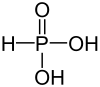
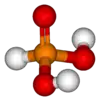
Фосфі́тна кислота́, фосфона́тна кислота́[4] — неорганічна сполука, двоосновна кислота складу H3PO3. Проявляє слабкі кислотні властивості, при взаємодії з основамі утворює ряд солей: фосфітів та гідрофосфітів. Утворює ряд фосфороорганічних сполук — фосфонатів.
| Фосфітна кислота | |
|---|---|
 |
 |
| Інші назви | ортофосфітна кислота, фосфонатна кислота |
| Ідентифікатори | |
| Номер CAS | 13598-36-2 |
| Номер EINECS | 237-066-7 |
| KEGG | C06701 |
| ChEBI | 44976 |
| RTECS | SZ6400000 |
| SMILES |
OP(O)=O[1] |
| InChI |
InChI=1S/H3O3P/c1-4(2)3/h4H,(H2,1,2,3) |
| Номер Бельштейна | 1209272 |
| Властивості | |
| Молекулярна формула | H3PO3, HPO(OH)2 |
| Молярна маса | 81,996 г/моль |
| Зовнішній вигляд | білі кристали |
| Густина | 1,65 г/моль[2] |
| Тпл | 74,4 °C[2] |
| Ткип | 200 °C[2] |
| Розчинність (вода) | 309 г/100 г H2O |
| Кислотність (pKa) | 1,3 (pK1); 6,70 (pK2)[3] |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-971,5 кДж/моль |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
За звичайних умов є білими гігроскопічним кристалами. Добре розчиняється у воді.
Фосфітна кислота використовується для отримання фосфітів, що застосовуються як стабілізатори при виробництві полівінілхлоридних смол; органічні похідні, фосфонати, використовуються як гербіциди, очисники води та компоненти лікарських засобів.
Структура
Відповідно до будови молекули, фосфітна кислотна є двоосновною, тому для позначення кількості «кислотних» атомів гідрогену інколи її формулу записують як HPO(OH)2 або ж, рідше, H2(HPO3).
Молекула кислоти може проявляти явище таутомерії та перебувати у формі тригідроксиду фосфору.
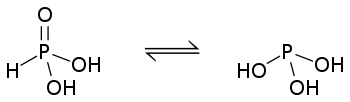
Отримання
Фосфітну кислоту вперше синтезував у 1777 році французький науковець Жорж-Луї Лесаж — у складі суміші оксoкислот фосфору при окисненні білого фосфору вологим повітрям:
Одним з основних способів отримання кислоти є гідроліз хлориду фосфору(III) в холодному тетрахлорметані як розчинникові:
Реакція має великий екзотермічний ефект внаслідок гідратації утвореної хлоридної кислоти. Для зменшення виділення тепла PCl3 розчиняють у концентрованій HCl. Згодом суміш нагрівають до 180 °C. Після охолодження фосфітна кислота виділяється з розчину у вигляді кристалів.
Для добування кислоти у промислових масштабах PCl3 впорскується у струмінь пари при 190 °C, а надлишок води, що не прореагував, та утворена хлоридна кислота видуваються струменем азоту при 165 °C.
Іншим поширеним методом синтезу кислоти є взаємодія оксиду фосфору(III) з холодною водою:
Хімічні властивості
При нагріванні фосфітної кислоти у вакуумі відбувається міжмолекулярна дегідратація, яка веде до утворення дифосфітної кислоти:
При більшому нагріванні відбувається диспропорціонування з утворенням фосфатної кислоти та фосфіну:
Фосфатна кислота також утворюється при обробці H3PO3 розігрітою водяною парою:
Фосфітна кислота є слабкою двоосновною кислотою:
- ; (pK1 = 1,3)
- ; (pK2 = 6,7)
При взаємодії кислоти із розведенимим лугами утворюються переважно монозаміщені солі, а з концентрованими — двозаміщені:
Сполука проявляє відновні властивості і при взаємодії з окисниками окиснюється до ортофосфатної кислоти:
Відновлюється активним воднем (в момент його виділення в результаті реакції металу з кислотою) до фосфіну:
Фосфонати
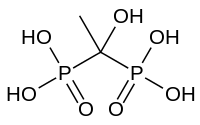
Фосфітна кислота HPO(OH)2 утворює ряд фосфороорганічних сполук — фосфонатів.
Продуктом взаємодії кислоти з оцтовим ангідридом (із наступним гідролізом) є 1-гідроксоетан-1,1-дифосфонатна кислота (едитронова кислота) — поширена складова лікарських засобів, відома під абревіатурою HEDP:
У реакції з формальдегідом та хлоридом амонію утворюється тризаміщений амін — амінотри(метиленфосфонатна кислота):
Застосування
Фосфітна кислота використовується для синтезу фосфітів, що застосовуються як добавки (стабілізатори) при виробництві полівінілхлоридних смол. Ряд органічних фосфонатів, отримуваних з кислоти, застосовується як гербіциди, очисники води та складові лікарських засобів.
Примітки
- Phosphonic acid — EBI.
- За тиску 101,3 кПа.
- При температурі 20 °C.
- Термін фосфонатна кислота здебільшого застосовується в органічній хімії, для позначення сполуки як прекурсору фосфонатів.
Джерела
- Greenwood N. N., Earnshaw A. Chemistry of the Elements. — 2nd. — Oxford : Butterworth-Heinemann, 1997. — P. 514-515. — ISBN 0-7506-3365-4. (англ.)
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Fee D. C., Gard D. R., Yang C. Phosphorus Compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 18. — P. 373-375. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Bettermann G. Phosphorus Compounds, Inorganic // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 6. — DOI: (англ.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)