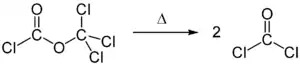Дифосген
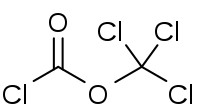
Дифосге́н — хімічна сполука ряду оксогалогенідів складу C2O2Cl4, трихлорометиловий естер хлорометанової кислоти. За звичайних умов речовина є прозорою, маслянистою рідиною.
| Дифосген | |
|---|---|
 | |
| Назва за IUPAC | Дифосген |
| Інші назви | трихлорометилхлороформіат, метилхлорокарбонат |
| Ідентифікатори | |
| Номер CAS | 503-38-8 |
| Номер EINECS | 207-965-9 |
| RTECS | LQ7350000 |
| SMILES |
C(=O)(OC(Cl)(Cl)Cl)Cl[1] |
| InChI |
InChI=1S/C2Cl4O2/c3-1(7)8-2(4,5)6 |
| Властивості | |
| Молекулярна формула | C2O2Cl4 |
| Молярна маса | 198,83 г/моль |
| Зовнішній вигляд | безбарвна масляниста рідина |
| Запах | свіжоскошене сіно |
| Густина | 1,6403 г/см³ (20 °C) |
| Тпл | -57 °C |
| Ткип | 128 °C (760 мм. рт. ст.) 41 °C (18 мм рт. ст.) |
| Тиск насиченої пари | 3 мм рт. ст. (0 °C) 5 мм рт. ст. (10 °C) 10,3 мм рт. ст. (20 °C) 16,3 мм рт. ст. (30 °C) |
| Показник заломлення (nD) | 1,4566 |
| Пов'язані речовини | |
| Пов'язані речовини | фосген, трифосген |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Дифосген був вперше синтезований у 1847 році. У Першій світовій війні активно застосовувався як хімічна зброя задушливої дії — як окрема речовина або у поєднанні з хлоропікрином та димоутворювачами. Вперше він був застосований Німеччиною у 1916 році проти французької армії у Верденській битві.
Дифосген використовується в ролі агенту хлорування, а також для отримання пластмас, барвників, синтетичних волокон.
Фізичні властивості
Дифосген є прозорою, рухливою маслянистою рідиною із запахом сіна. Слабко розчиняється у воді, при цьому розкладається. Добре розчиняється в органічних розчинниках, мастилах.
Максимальна концентрація у повітрі при 20 °C — 120 мг/л. Леткість сполуки складає 12 г/м³ при 0 °C, 45 г/м³ при 20 °C, 270 г/м³ при 51,7 °C.
Отримання
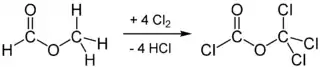
Дифосген отримують хлоруванням метилового естеру метанової кислоти при дії ультрафіолетового випромінювання:
Утворений продукт являє собою суміш моно-, ди- та трихлоропохідних. Їхнє розділення проводять фракційною перегонкою, проте воно дещо ускладнене близькістю температур кипіння: монопохідна кипить за 107 °C, дихлоропохідна — за 110 °C, а трихлоропохідна — за 128 °C.
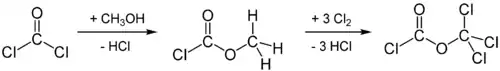
Також застосовується метод синтезу із фосгену: при дії на нього метанолу утворюється естер, який у подальшому хлорують:
Хімічні властивості
При нагріванні понад 350 °C дифосген розкладається:
Він може розкладатися вже за кімнатної температури у присутності каталізаторів: активованого вугілля, AlCl3, FeCl3, SnCl2, оксидів заліза. При дії AlCl3 або FeCl3 утворюється переважно тетрахлорметан і оксид вуглецю:
Гідроліз дифосгену відбувається значно повільніше, аніж у фосгену. Сприяє процесу нагрівання та дія лужних сполук. При кип'ятінні у водному розчині сполука повністю розкладається за кілька хвилин:
У хімічних взаємодіях дифосген проявляє властивості оксогалогенідів та естерів. Подібно до фосгену, дифосген активно реагує з аміаком, амінами із утворенням сечовини та її похідних:
Токсичність

За своєю токсиною дією дифосген подібний до фосгену. Він є токсичним лише при його інгаляції, у рідкому стані крізь шкіру не проникає і може залишити тільки невеликі опіки. Пара дифосгену подразнює дихальні шляхи.
Подразнююча дія на очі проявляється за концентрації у 0,005 мг/л. Концентрація 0,04 мг/л є прийнятною при контакті не більше 1 хвилини, а дози 1 мг/л протягом 5 хв. є смертельними. Для 15-хвилинної дії смертельною є концентрація 0,5—0,7 мг/л.
Принцип дії дифосгену на організм полягає у його реакції із ліпідами-складовими стінок клітин легеневих тканин, що призводить до збільшення проникності мембран. В результаті цього крізь них просочується плазма крові і стається набряк легенів. Це спричинює порушення газообміну, нестачу кисню і врешті-решт смерть.
Симптоми отруєння речовиною проявляються через 6—8 годин після контакту із нею. Захистом від дифосгену слугує протигаз.
Військові позначення
У Першій світовій війні застосовувалася суміш дифосгену із фосгеном та хлоропікрином, що отримала назву «Зелений хрест» (нім. Grünkreuz).
У різних країнах дифосген має такі назви і позначення:
- США — DP
- Німеччина — Perstoff, Grünkreuz
- Франція — Surpalite
- Велика Британія — Superpalite, Diphosgene
Примітки
- DIPHOSGENE
Джерела
- Hoenig S. L. Compendium of Chemical Warfare Agents. — New York : Springer, 2007. — 222 p. — ISBN 0-387-34626-0. (англ.)
- Александров В., Емельянов В. Отравляющие вещества. — 2-е изд, переработанное и доп. — М. : Военное издательство, 1990. — 272 с. — ISBN 5-203-00341-6. (рос.)
- Франке З. Химия отравляющих веществ. — М. : Химия, 1973. — Т. 1. — 440 с. (рос.)
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)