Аміни
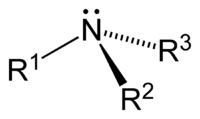
Амі́ни — азотовмісні органічні хімічні сполуки, похідні аміаку (NH3), в якому щонайменш один атом водню заміщений аліфатичним або ароматичним вуглеводневим фрагментом.
Загальний опис
Якщо амін містить одну вуглеводневу групу, він називається первинним аміном (формула RNH2), якщо дві — вторинним аміном (R2NH), а якщо три — третинним аміном (R3N). Четвертинні аміни мають чотири замісники на атомі азоту, внаслідок чого вони мають електричний заряд +1.
Залежно від природи радикалів аміни називаються: аліфатичними, ароматичними та гетероциклічними; останній термін відноситься до азотовмісних гетероциклів. Нижчі аліфатичні аміни — гази, вищі — рідини й тверді речовини. Аміни з коротким вуглеводневими ланцюгом добре розчинюються у воді, зі збільшенням довжини вуглеводневого радикалу розчинність амінів зменшується. Найважливішим ароматичним аміном є анілін.
Отримання
Оскільки атом азоту в амінах формально має ступінь окиснення -III, їх отримують відновленням інших азотовмісних органічних сполук (нітро- та нітрозосполук, а також алкілгідроксиламінів, нітрилів тощо). Для цього застосовується реакція гідрогенування в присутності нікелевого каталізатора:
Також аміни можна отримати прямим алкілюванням аміаку. Для цього до надлишку аміаку додають, наприклад, йодметан. Потім до солі, що утворилася, додають аміак:
Проте, недоліками цього методу є замалий спектр можливих продуктів, а також неможливість контролювати перебіг реакції: так, щойно утворені первинні аміни охоче реагують з наступним еквівалентом йодоалкану, утворюючи вторинні, третинні, і навіть четвертинні аміни.
Аміак також можна алкілювати за допомогою спиртів. Цим способом можна отримати первинні, вторинні й третинні аміни:
Ще аміни можна отримати шляхом додавання аміаку до альдегідів та кетонів і послідовним каталітичним гідрогенуванням утвореного іміну:
Для отримання вторинних амінів замість аміаку використовують первинні аміни, а для третинних — вторинні.
Аміни також отримують дією на аміди карбонових кислот розчинів брому (хлору) у гідроксиді калію (натрію); ця реакція відома як перегрупування за Гофманом. Вона протікає в декілька етапів:
- Спочатку молекула брому взаємодіє з амідом, заміщуючи атом гідрогену на атом брому: (луг нейтралізує кислоту, яка утворилася)
- Далі гідроксид калію розпадається на іони. Гідроксид-іон відриває від молекули, що утворилася, протон, а його місце займає іон калію:
- Потім від цієї молекули відщеплюється бромід калію:
- Молекула, яка залишилася, нестабільна, тому атом нітрогену переходить у місце між радикалом та карбонілом:
- До цієї молекули приєднується молекула води, яка утворилася на другому етапі реакції. Атом оксигену приєднується до карбонільної групи, утворюючи вуглекислий газ, а два атома гідрогену — до атома нітрогену:

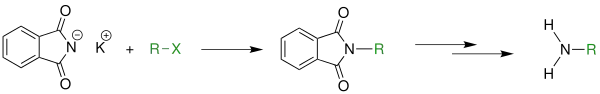
Первинні аміни також можна селективно отримати за допомогою синтезу Габрієля:
Хімічні властивості
Основні властивості
Аміни проявляють основні властивості через наявність у атома азоту неподіленої електронної пари. При взаємодії з кислотами вони утворюють амонієві солі:
Основні властивості в аліфатичних амінів проявляються сильніше, ніж в аміаку. У вторинних вони проявляються сильніше, ніж у первинних, а у третинних — найсильніше. Це пов'язано з +I-еффектом радикалів: електронна густина на атомі азоту збільшується, внаслідок чого він сильніше притягує протон.
Проте це правило не працює, якщо амін знаходиться у водному розчині: вторинні аміни сильніші за третині. Це пов' язано з тим, що стійкість катіону збільшується при наявності сольватної оболонки. Сольватна оболонка утворюється завдяки водневим зв'язкам між атомом оксигену з води та атомом гідрогену з аміну, доступ до якого у третинних амінів утруднений.
Але основні властивості ароматичних амінів проявляються слабше, ніж в аміаку через спряження неподіленної електронної пари нітрогену з π-електронами ароматичного ядра.
Аліфатичні аміни
Однією з важливих реакцій аліфатичних амінів є взаємодія їх з HNO2: первинні аміни при цьому утворюють спирти, вторинні — нітрозаміни, третинні не реагують.
Реакція протікає у декілька етапів:
- Спочатку нітритна кислота реагує з іншою сильною кислотою (наприклад, хлоридною або сульфатною) і приєднує протон, утворюючи протоновану кислоту .
- Далі ця протонована кислота може розпастися на нітрозоній-катіон та воду:
- Нітрозоній-катіон приєднується до іншої молекули HNO2, утворюючи триоксид діазоту:
- Триоксид діазоту розпадається на О-N=O та N=O. O-N=O відщеплює атом гідрогену від аміногрупи, а нітрозогрупа приєднується на його місце, утворюючи нітрозамін: або На цьому етапі реакція для вторинних амінів завершується. У подальших етапах беруть участь лише первинні аміни.
- Нітрозамін, що утворився, може перейти в діазогідрат:
- Діазогідрат приєднує протон, а потім від цього катіона відщеплюється вода:
- Від нітрена, який утворився, відщеплюється азот:
- До радикал-іона приєднується молекула води, утворюючи оксонієвий катіон, від якого відривається протон:
Ароматичні аміни
(Про реакцію первинних аміннв)
Ароматичні аміни також по-різному реагують з нітритною кислотою в залежності від порядку аміну. Первинні ароматичні аміни у кислому середовищі утворюють діазосполуки:
Вторинні ароматичні аміни так само, як і аліфатичні, утворюють нітрозоаміни. При нагріванні нітрозогрупа вступає в реакцію перегрупування, внаслідок чого утворюються п-нітрозоалкіл(або арил)аніліни:
Третинні ароматичні аміни утворюють п-(або о-, якщо п-положення зайняте)нітрозопохідні:
Застосування
Аміни широко використовуються в анілофарбувальній та фармацевтичній промисловості, наприклад, як складники реагентів при флотації та масляній агломерації (грануляції, флокуляції) вугілля.
Див. також
Джерела
- Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.
- Vollhard, Kurt Peter C.; Schore, Neil Eric (2011). Organische Chemie (нім.) (вид. 5). Weinheim: Wiley-VCH. ISBN 3-527-32754-1. OCLC 760140825.