Елвітегравір
Елвітегравір — (міжнародна транскрипція EVG) — синтетичний противірусний препарат з групи інгібіторів інтегрази для прийому всередину. Елвітегравір розроблений компанією «Gilead Sciences» за участю компанії «Japan Tobacco» та ліцензований у 2005 році.[1][2][3] Елвітегравір пройшов ІІІ фазу клінічних досліджень у США з 2008 до 2011 року[1] та після успішного завершення дослідження[4] був затверджений FDA 27 серпня 2012 року[5] як комбінований препарат разом із тенофовіром, емтрицитабіном та кобіцистатом.[6] У травні 2013 року елвітегравір був схвалений Європейською Комісією та допущений до використання на території ЄС.[7] У листопаді 2013 року елвітегравір був схвалений Єврокомісією для застосування як монопрепарат[8], а у вересні 2014 року як монопрепарат був затверджений і у США.[9]
 | |
 | |
| Систематична назва (IUPAC) | |
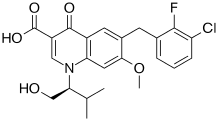
| 6-[(3-Chloro-2-fluorophenyl)methyl]-1-[(2S)-1-hydroxy-3-methylbutan-2-yl]-7-methoxy-4-oxoquinoline-3-carboxylic acid | |
| Ідентифікатори | |
| Номер CAS | |
| Код ATC | J05 |
| PubChem | |
| Хімічні дані | |
| Формула | C23H23ClFNO5 |
| Мол. маса | 447,883 г/моль |
| SMILES | & |
| Фармакокінетичні дані | |
| Біодоступність | НД |
| Метаболізм | гепатичний |
| Період напіврозпаду | 12,9 год. |
| Виділення | фекалії (93%), нирковий(7%) |
| Терапевтичні застереження | |
| Кат. вагітності |
B(США) |
| Лег. статус | |
| Використання | перорально |
Фармакологічні властивості
Елвітегравір — синтетичний противірусний препарат з групи інгібіторів інтегрази. Механізм дії препарату полягає у інгібуванні каталітичної активності ферменту вірусу ВІЛ — інтегрази, необхідної для реплікації вірусу в геном клітини господаря, що приводить до утворення неактивних вірусних частинок та гальмування подальшого поширення інфекції в організмі людини. До елвітегравіру чутливий виключно вірус ВІЛ-1. Під час проведення клінічних досліджень підтверджено вищу ефективність застосування елвітегравіру в порівнянні із ралтегравіром у пацієнтів з високим вірусним навантаженням, які раніше застосовували традиційні схеми ВААРТ[1][4], та у комбінації з ритонавіром вищу ефективність, ніж посилені ритонавіром інгібітори протеази.[10] Елвітегравір рекомендовано застосовувати разом із ритонавіром або іншим фармакокінетичним підсилювачем (бустером) кобіцистатом.
Фармакокінетика
Елвітегравір при прийомі всередину відносно повільно всмоктується, максимальна концентрація в крові досягається протягом 4 годин. Біодоступність препарату не досліджена. Препарат добре зв'язується з білками плазми крові. Даних за проникнення препарату через гематоенцефалічний бар'єр немає. Невідомо, чи елвітегравір проникає через плацентарний бар'єр та виділяється в грудне молоко. Метаболізується препарат в печінці з утворенням неактивних метаболітів, виводиться з організму переважно з калом (93%), частково виводиться нирками (7%) у вигляді неактивних метаболітів. Період напіввиведення елвітегравіру становить 12,9 години[11], немає даних про збільшення цього часу при порушеннях функції печінки та нирок.
Показання до застосування
Елвітегравір застосовується для лікування інфекції, спричиненої вірусом ВІЛ-1 у складі комбінованої терапії у дорослих та дітей старших 12 років. Монотерапія препаратом не застосовується у зв'язку з швидким розвитком резистентності вірусу ВІЛ до препарату.
Побічна дія
При застосуванні елвітегравіру найчастішими побічними явищами є діарея (7,1% випадків застосування), нудота (4%)[8] і головний біль (3%). Значно рідше спостерігають біль в животі, блювання, швидку втомлюваність, свербіж шкіри, депресію, безсоння, а у осіб із попереднім психіатричним анамнезом — суїцидальні думки та суїцидальні спроби. У лабораторних аналізах можуть виявити нейтропенію, гіперглікемію, гіперхолестеринемію, гіпертригліцеридемію, гематурію, глюкозурію, підвищення активності амінотрансфераз, гаммаглютамілтранспептидази (ГГТП), креатинфосфокінази, підвищення в крові рівня білірубіну. При проведенні ВААРТ у хворих зростає імовірність розвитку серцево-судинних ускладнень, гіперглікемії та гіперлактатемії. Під час проведення ВААРТ зростає імовірність синдрому відновлення імунної системи із загостренням латентних інфекцій.
Протипокази
Елвітегравір протипоказаний при підвищеній чутливості до препарату. З обережністю застосовують препарат при вагітності та годуванні грудьми.
Форми випуску
Елвітегравір випускається у вигляді таблеток по 0,085 та 0,15 г. Розроблено комбінований препарат елвітегравіру разом із тенофовіром, емтрицитабіном та кобіцистатом.[6][8]
Примітки
- http://arvt.ru/news/2011-03-25-elvitegravir-48week-phaseIII.html (рос.)
- Shimura K, Kodama E, Sakagami Y, et al. (2007). Broad Anti-Retroviral Activity and Resistance Profile of a Novel Human Immunodeficiency Virus Integrase Inhibitor, Elvitegravir (JTK-303/GS-9137). J Virol 82 (2): 764–74. PMC 2224569. PMID 17977962. doi:10.1128/JVI.01534-07. (англ.)
- Stellbrink HJ (2007). Antiviral drugs in the treatment of AIDS: what is in the pipeline ?. Eur. J. Med. Res. 12 (9): 483–95. PMID 17933730. (англ.)
- http://clinical-pharmacy.ru/digest/klinic-issledovaniya/1110-rezultaty-iii-fazy-klinicheskogo-issledovaniya-po-ocenke-effektivnosti-preparata-elvitegravir-pri-terapii-vich-1.html (рос.)
- http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(12)60917-9/abstract
- http://clinical-pharmacy.ru/digest/new-lekarstva/1987-novyy-kombinirovannyy-preparat-protiv-vich-infekcii-stribild-stribild-poluchil-odobrenie-fda.html (рос.)
- http://clinical-pharmacy.ru/digest/new-lekarstva/3152-evrokomissiya-odobrila-preparat-stribild-dlya-lecheniya-vich-infekcii.html (рос.)
- http://itpcru.org/2013/11/19/v-nbsp-es-nbsp-zaregistrirovan-ingibitor-integrazy-laquo-vitekta-raquo-elvitegravir (рос.)
- «FDA Approval Bulletin» Архівовано 3 листопада 2014 у Wayback Machine. (англ.)
- Thaczuk, Derek and Carter, Michael. ICAAC: Best response to elvitegravir seen when used with T-20 and other active agents Архівовано 2 січня 2010 у Wayback Machine. (англ.)
- http://www.hiv-druginteractions.org/data/FactSheetImages/FactSheet_DrugID_662.pdf Архівовано 2 квітня 2015 у Wayback Machine. (англ.)
Джерела
- «Vitekta Package Insert» (англ.)