Кальретикулін
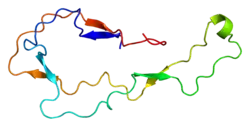
Кальретикулін (англ. Calreticulin) – білок, який кодується геном CALR, розташованим у людей на короткому плечі 19-ї хромосоми. [3] Довжина поліпептидного ланцюга білка становить 417 амінокислот, а молекулярна маса — 48 142[4].
Послідовність амінокислот
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MLLSVPLLLG | LLGLAVAEPA | VYFKEQFLDG | DGWTSRWIES | KHKSDFGKFV | ||||
| LSSGKFYGDE | EKDKGLQTSQ | DARFYALSAS | FEPFSNKGQT | LVVQFTVKHE | ||||
| QNIDCGGGYV | KLFPNSLDQT | DMHGDSEYNI | MFGPDICGPG | TKKVHVIFNY | ||||
| KGKNVLINKD | IRCKDDEFTH | LYTLIVRPDN | TYEVKIDNSQ | VESGSLEDDW | ||||
| DFLPPKKIKD | PDASKPEDWD | ERAKIDDPTD | SKPEDWDKPE | HIPDPDAKKP | ||||
| EDWDEEMDGE | WEPPVIQNPE | YKGEWKPRQI | DNPDYKGTWI | HPEIDNPEYS | ||||
| PDPSIYAYDN | FGVLGLDLWQ | VKSGTIFDNF | LITNDEAYAE | EFGNETWGVT | ||||
| KAAEKQMKDK | QDEEQRLKEE | EEDKKRKEEE | EAEDKEDDED | KDEDEEDEED | ||||
| KEEDEEEDVP | GQAKDEL |
Цей білок за функцією належить до шаперонів. Білок має сайт для зв'язування з іонами металів, іоном цинку, іоном кальцію, лектинами. Локалізований у цитоплазмі, позаклітинному матриксі, ендоплазматичному ретикулумі, саркоплазматичному ретикулумі. Також секретований назовні.
Література
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Lieu T.-S., Newkirk M.M., Capra J.D., Sontheimer R.D. (1988). Molecular characterization of human Ro/SS-A antigen. Amino terminal sequence of the protein moiety of human Ro/SS-A antigen and immunological activity of a corresponding synthetic peptide.. J. Clin. Invest. 82: 96 — 101. PubMed DOI:10.1172/JCI113607
- Rojiani M.V., Finlay B.B., Gray V., Dedhar S. (1991). In vitro interaction of a polypeptide homologous to human Ro/SS-A antigen (calreticulin) with a highly conserved amino acid sequence in the cytoplasmic domain of integrin alpha subunits.. Biochemistry 30: 9859 — 9866. PubMed DOI:10.1021/bi00105a008
- Krause K.-H., Simmerman H.K.B., Jones L.R., Campbell K.P. (1990). Sequence similarity of calreticulin with a Ca2(+)-binding protein that co-purifies with an Ins(1,4,5)P3-sensitive Ca2+ store in HL-60 cells.. Biochem. J. 270: 545 — 548. PubMed DOI:10.1042/bj2700545
- Dupuis M., Schaerer E., Krause K.-H., Tschopp J. (1993). The calcium-binding protein calreticulin is a major constituent of lytic granules in cytolytic T lymphocytes.. J. Exp. Med. 177: 1 — 7. PubMed DOI:10.1084/jem.177.1.1
- Nauseef W.M., McCormick S.J., Clark R.A. (1995). Calreticulin functions as a molecular chaperone in the biosynthesis of myeloperoxidase.. J. Biol. Chem. 270: 4741 — 4747. PubMed DOI:10.1074/jbc.270.9.4741
Примітки
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:1455 (англ.). Процитовано 30 січня 2017.
- UniProt, P27797 (англ.). Процитовано 30 січня 2017.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.