Ортофосфат кальцію
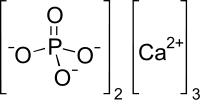
О́ртофосфа́т ка́льцію, фосфа́т ка́льцію[4] — неорганічна сполука, кальцієва сіль ортофосфатної кислоти складу Ca3(PO4)2. Речовина є білим аморфним порошком, що погано розчиняється у воді.
| Ортофосфат кальцію | |
|---|---|
 | |
| Назва за IUPAC | трикальцій біс(фосфат)[1] |
| Інші назви | кальцій ортофосфат, фосфат кальцію, трикальцій фосфат |
| Ідентифікатори | |
| Номер CAS | 7758-87-4 |
| Номер EINECS | 231-840-8 |
| KEGG | C08136 і D00938 |
| ChEBI | 9679 |
| SMILES |
[O-]P(=O)([O-])[O-].[O-]P(=O)([O-])[O-].[Ca+2].[Ca+2].[Ca+2][2] |
| InChI |
InChI=1S/3Ca.2H3O4P/c;;;2*1-5(2,3)4/h;;;2*(H3,1,2,3,4)/q3*+2;;/p-6 |
| Властивості | |
| Молекулярна формула | Ca3(PO4)2 |
| Молярна маса | 310,18 г/моль |
| Зовнішній вигляд | білий аморфний порошок |
| Густина | 3,14 г/см³ |
| Тпл | 1670 °C |
| Розчинність (вода) | 0,0025 г/100 г[3] |
| Розчинність (етанол) | нерозчинний |
| Показник заломлення (nD) | 1,63 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-4120,8 кДж/моль |
| Ст. ентропія S |
236,0 Дж/(моль·K) |
| Теплоємність, c |
227,8 Дж/(моль·K) |
| Пов'язані речовини | |
| Інші аніони | гідрофосфат кальцію, дигідрофосфат кальцію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Для ортофосфату відомі дві кристалічні модифікації: високотемпературна α-форма і низькотемпературна β-форма. Перехід між ним відбувається за температури 1180 °C.[3]
Ортофосфат кальцію широко застосовується у сільському господарстві як фосфатне добриво. У харчовій промисловості він використовується як емульгатор, регулятор кислотності, поліпшувач тіста тощо.
Поширення у природі
Фосфат кальцію поширений у земній корі у вигляді мінералів флуорапатиту Ca5(PO4)3F або CaF2·3Ca3(PO4)2, гідроксиапатиту Ca5(PO4)3OH, вітлокіту Ca3(PO4)2 та багатьох інших фосфоритових осадових породах.
Ортофосфат складає значну частку кісткової тканини у тварин, тому, отриманий із розмелених кісток, фосфат кальцію також має технічну назву кісткове борошно.
Отримання
У промислових масштабах ортофосфат кальцію синтезують взаємодією ортофосфатної кислоти із суспензією гідроксиду кальцію (гашеного вапна) з подальшою фільтрацією, сушінням та розмелюванням:
За своїм складом кінцевий продукт є ближчим до гідроксифосфату Ca5(OH)(PO4)3, оскільки містить домішки вапна. Співвідношення Ca:P залежить від умов проведення нейтралізації і може змінюватися у діапазоні 1,3-2,0. Чистий ортофосфат кальцію (співвідношення 1,5 або 3:2) отримують після проведення кальцинації продукту за температури 900 °C.
Іншим методом отримання ортофосфату є взаємодія солей кальцію (хлориду або нітрату) із гідрофосфатами у присутності аміаку:
Хімічні властивості
Ортофосфат кальцію не розчиняється у воді, проте розчиняється у деяких кислотах:
При спіканні з коксом чи алюмінієм ортофосфат відновлюється до фосфіду кальцію, а у присутності діоксиду кремнію формує силікат кальцію:
Застосування
Ортофосфат кальцію застосовується в агрономії як фосфатне добриво і поширений під технічною назвою фосфоритне борошно. При отриманні такого добрива шляхом розмелювання природних фосфатів, воно має низьку вартість. Добриво застосовується на кислих ґрунтах, його ефективність суттєво підвищується при використанні разом із торфом та гноєм, а також фізіологічно-кислими добривами.[5]
Добавка ортофосфату кальцію до зубних паст поліпшує їхні полірувальні властивості. Ортофосфат додається до харчових продуктів, зокрема, кухонної солі, цукру у кількість 1—2%. Його використання у харчовій промисловості регламентоване Продовольчою та сільськогосподарською організацією ООН: ортофосфат кальцію зареєстрований як харчова добавка із порядковими номерами E341 та E542. Він має властивості харчового емульгатора, регулятора кислотності, поліпшувача тіста, розпушувача, вологоутримувача, антиспікаючого агента.[6]
Ортофосфат застосовується у виробництві люмінесцентних матеріалів.
Див. також
Примітки
- Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005. — Cambridge : RSC Publishing, 2005. — P. 77. — ISBN 0-85404-438-8. (англ.)
- Calcium phosphate
- Schrödter K., Bettermann G., Staffel T., Wahl F., Klein T., Hofmann T. Phosphoric Acid and Phosphates // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- У практичному відношенні ортофосфати мають найбільше значення серед усіх фосфатних сполук, тому термін фосфати зазвичай відносять саме до них.
- Добрива та їх використання: Довідник. — К. : Арістей, 2010. — 254 с. — ISBN 978-966-381-021-8.
- Class Names and the International Numbering System for Food Additives — Food and Agriculture Organization of the United Nations.[недоступне посилання з червня 2019] (англ.)
Джерела
- Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Gard D. R. Phosphoric Acids and Phosphates // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 6. — P. 334. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Lange's Handbook of Chemistry / John A. Dean. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Schrödter K., Bettermann G., Staffel T., Wahl F., Klein T., Hofmann T. Phosphoric Acid and Phosphates // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / Под ред. В. И. Спицына. — М. : «Мир», 1972. — Т. 2. — 871 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
