Саліциловий альдегід
Саліциловий альдегід (саліцилальдегід, 2-гідроксибензальдегід) — органічна сполука з класу альдегідів та фенолів. Хімічна формула — .
| Структурна формула | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Загальна інформація | ||||||||||||||||
| Преференційна назва ІЮПАК | ||||||||||||||||
| Систематична назва ІЮПАК | 2-гідроксибензальдегід | |||||||||||||||
| Інші назви |
Саліциловий альдегід, саліцилальдегід | |||||||||||||||
| Хімічна формула | C7H6O2 | |||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | |||||||||||||||
| Зовнішні ідентифікатори / Бази даних | ||||||||||||||||
| ||||||||||||||||
| Властивості | ||||||||||||||||
| Молярна маса | 122.036779 г/моль | |||||||||||||||
| Агрегатний стан |
Рідина | |||||||||||||||
| Зовнішній вигляд |
Безбарвна чи жовтувата рідина | |||||||||||||||
| Густина |
1.1674 (20 °C) | |||||||||||||||
| Температура плавлення |
-7 °C | |||||||||||||||
| Температура кипіння |
197 °C | |||||||||||||||
| Термодинамічні властивості | ||||||||||||||||
| ΔcH⦵298 |
-27.29 кДж/г при 20 °C | |||||||||||||||
| Безпека | ||||||||||||||||
| Маркування згідно системі УГС
Увага | ||||||||||||||||
| H-фрази | H: H302, H312, H315, H319, H341 | |||||||||||||||
| P-фрази | P: P201, P202, P264, P270, P280, P281, P301+P312, P302+P352, P305+P351+P338, P308+P313, P312, P321, P322, P330, P332+P313, P337+P313, P362, P363, P405, P501 | |||||||||||||||
| LD50 |
504 мг/кг (миші, орально) | |||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | ||||||||||||||||
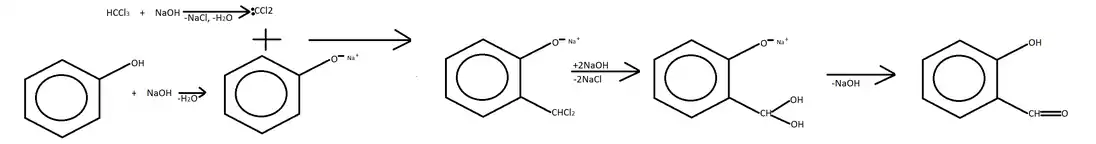
Отримання
Отримують взаємодією фенолу, хлороформу та гідроксиду натрію чи калію. На першій стадії відбувається дегідрогалогенування хлороформу з утворенням дихлорокарбену. Оскільки карбени є дуже реакцієздатними частинками, вони приєднуються до фенолят-аніону з утворенням орто-дихлорометилфенолу. Під дією лугу він гілролізується, утворюючи орто-дигідроксиметилфенол. Оскільки орто-дигідроксиметилфенол містить дві гідроксильні групи біля одого атому карбону, він є нестійким і відщеплює воду з утворенням натрієвої солі саліцилальдегіду. Вода гідролізує сіль, утворюючи вільний саліциловий альдегід. Реакція називається реакцією Реймана-Тіммана[1]:
Хімічні властивості
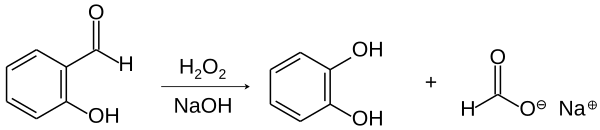
Окиснення
При окисненні утворює саліцилову кислоту або пірокатехол. При окисненні киснем повітря утворюється саліцилова кислота[1]:
Реакція протікає за радикальним механізмом[2]:
(На цьому етапі для нової молекули альдегіду, яка дає атом гідрогену, розпочинається ця реакція)
При окисненні пероксидом водню у лужному середовищі утворюється пірокатехол[1]:
Хлорування
На відміну від аліфатичних альдегідів, саліцилальдегід, як і інші ароматичні альдегіди, легко хлорується, утворюючи хлороангідрид саліцилової кислоти:[1]
Взаємодія з первинними амінами
При взаємодії з первинними амінами утворюються основи Шиффа:


