Пероксид водню
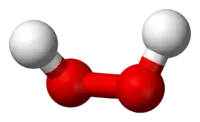
Пероксид водню (також пероксид гідрогену, пере́кис во́дню, лат. Hydrogen peroxide) — бінарна сполука гідрогену з оксигеном складу . У молекулі наявний ковалентний зв'язок між атомами оксигену.
| Пероксид водню | |
|---|---|
 | |
| Інші назви | Пероксид гідрогену, перекис водню, пергідроль |
| Ідентифікатори | |
| Номер CAS | 7722-84-1 |
| PubChem | 784 |
| Номер EINECS | 231-765-0 |
| DrugBank | 11091 |
| KEGG | D00008 |
| Назва MeSH | D01.248.497.158.685.750.424, D01.339.431.374.424, D01.650.550.750.400 і D02.389.338.253 |
| ChEBI | 16240 |
| RTECS | MX0900000 |
| Код ATC | A01AB02 |
| SMILES |
OO |
| InChI |
InChI=1S/H2O2/c1-2/h1-2H |
| Номер Бельштейна | 3587191 |
| Номер Гмеліна | 509 |
| Властивості | |
| Молекулярна формула | H2O2 |
| Молярна маса | 34,01 г/моль |
| Зовнішній вигляд | Прозора безбарвна рідина |
| Густина | 1,4 г/см³ |
| Тпл | -0,432 °C |
| Ткип | 150,2 °C |
| Розчинність (вода) | необмежена |
| Кислотність (pKa) | 11,6 |
| Небезпеки | |
| Індекс ЄС | 008-003-00-9 |
| Класифікація ЄС | |
| R-фрази | R34 R8 |
| S-фрази | S28 S3 S36/39 S45 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія відкриття
Пероксид водню вперше добув французький хімік Луї Жак Тенар в 1818 році дією кислоти на барій пероксид [1]. Метод добування чистого пероксиду за реакцією: BaO2 + H2SO4 = BaSO4↓ + Н2О2 в наш час має лише історичне значення.
Отримання
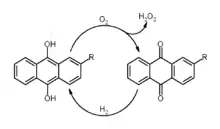
Основний промисловий спосіб (понад 80% світового виробництва) — окиснення антрагідрохінону, див. схему. Також застосовують анодне окиснення сульфатної кислоти в розведеному розчині:
- 2H2SO4 - 2e- = H2S2O8 + 2H+,
- H2S2O8 + H2O = H2SO5 + H2SO4,
- H2SO5 + H2O = H2O2 + H2SO4.
Промисловий продукт — водний розчин із вмістом від 30% до 90%. Пергідроль[2] — це 30%(35%) розчин пероксиду водню, що містить стабілізаційні добавки.
Фізичні властивості
Безбарвна рідина. Змішується з водою в будь-якому співвідношенні. Розчинний в етанолі, діетиловому етері. Утворює кристалосольвати, найвідоміший із яких із карбамідом — гідроперит · ; вони використовуються як тверді носії пероксиду водню. Переганяють під зниженим тиском при 80 °C.
Хімічні властивості
Доволі нестійка хімічна сполука, здатна спонтанно розкладатися на кисень та воду.
- 2Н2О2 = 2Н2О + O2↑
В чистому вигляді термічно стійка, забруднення солями важких металів суттєво збільшує швидкість розкладу, який може відбуватися з вибухом. Концентровані розчини є вибухонебезпечними і можуть спричиняти займання при контакті з горючими речовинами. Стійкість водних розчинів збільшується з додаванням кислоти та максимальна при pH 3,5-4,5.
Молекула пероксиду водню здатна розпадатися двома шляхами:
- Н2О2 → 2Н2О + O: (окиснювальний розпад)
- Н2О2 → 2OH· (вільнорадикальний розпад)
Завдяки проміжному ступеню окиснення оксигену (-1), пероксид водню здатен виявляти властивості як окисника (відновлюється до O−2), так і відновника (окиснюється до кисню). Тож його розклад слід розглядати як реакцію диспропорціонування.
Окисник:
- H2O2 + 2HI = I2 + 2H2O
- H2O2 + SO2 = H2SO4
- 4H2O2 + PbS↓ = PbSO4↓ + 4H2O
- H2O2 + C6H6 → C6H5OH + H2O
- H2O2 + C2H4 → C2H4O + H2O
Відновник:
- H2O2 + Ag2O↓ = 2Ag↓ + H2O + O2↑
- 5H2O2 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 5O2↑
Здатен заміщувати гідроксильну групу на гідропероксидну (приміром, при добуванні надкислот) або на пероксидну (утворення пероксидів металів).
Здатен приєднуватися по подвійному зв'язку органічної молекули з утворенням двоатомних спиртів — гліколів:
- H2O2 + C2H4 → CH2OH-CH2OH (водний розчин, кислотний каталіз)
Біологічна дія
У біологічних системах токсичний, оскільки утворює вільні радикали. Знешкоджується з допомогою ферментів антиоксидативного захисту у цитоплазмі клітини та деяких органелах, зокрема мітохондріях та пероксисомах.

Більш концентровані розчини спричиняють опіки шкіри, слизових оболонок та дихальних шляхів; ГДК в повітрі встановлено на рівні 1,4 мг/м³. Білий колір опіку пояснюється окисненням ліпідів, як наслідок епідермальний шар шкіри стає малопрозорим. Через декілька днів ліпідні оболонки оновлюються, опік пергідролем проходить безслідно.
Застосування

Для відбілювання паперу, шкіри, хутра, текстильних матеріалів, олій, жирів. Окисник у складі ракетних палив. Дезінфекційний засіб для знешкодження побутових та промислових стічних вод. В хімічному синтезі: для добування органічних і неорганічних пероксидів, також епоксидів, гліколів тощо.
Медицина
Користують, як водний розчин, так і у поєднанні з іншими сполуками[3] (наприклад, для приготування антисептика C4).
Застосовують як дезінфектант для медичного інструментарію та певного виду медичного оснащення.
Існують суперечки щодо ефективності перекису водню при лікуванні ран[3][4][5][6][7][8].
Історично перекис водню застосовували для антисептичного та механічного очищення ран, частково через низьку вартість та швидку доступність у порівнянні з іншими антисептиками, також чітку кровоспинну дію[9].
Зараз[коли?] вважається, що гальмує загоєння і може провокувати появу рубців, оскільки він руйнує новоутворені клітини шкіри[джерело?]. Одне дослідження показало[джерело?], що лише дуже низькі концентрації (0,15% розчин, це розведення типового 3% пероксиду в 20 разів) можуть сприяти загоєнню, і лише якщо їх не застосовувати повторно. Було виявлено, що 0,5% розчин перешкоджає загоєнню.
Використовується для лікування ран у багатьох країнах, в Україні також є поширеним як місцевий антисептик та місцевий кровоспинний для надання першої допомоги.
Застосовується для лікування варикозної хвороби судин нижніх кінцівок[10], у тому числі внутрішньовенно[11]; як компонент другого етапу лікування після неефективної антибактеріальної терапії при інфекції золотистим стафілококом[12], в отоларингології як місцевий протимікробний засіб.
Див. також
Примітки
- L. J. Thénard (1818). Observations sur des nouvelles combinaisons entre l’oxigène et divers acides. Annales de chimie et de physique, 2nd series 8: 306–312. (фр.)
- ПЕРГІДРОЛЬ
- Chemical Disinfectants/ Guideline for Disinfection and Sterilization in Healthcare Facilities (2008)
- Чому перекис водню не працює і які засоби використовувати МОЗУ, 2018
- Лікування кровотеч
- Photometric analysis. LOVIBOND®. Photometry Lovibond®. Hydrogen peroxide pills. Detection range: 0,03-3mg/l H2O2. Number of pills, tests or ml: 100
- Cytochemical Localization of H2O2 in Biological Tissues. E. Ann Ellis. DOI:10.1385%2F1-59259-274-0%3A0310.1385/1-59259-274-0:03 2002
- Dermal wound healing is subject to redox control (on mouses) doi:10.1016/j.ymthe.2005.07.684 2005
- ВОДНЮ ПЕРОКСИДУ РОЗЧИН 30%
- ВИКОРИСТАННЯ МЕТОДУ ВНУТРІШНЬОВЕННОГО ВВЕДЕННЯ РОЗЧИНУ ПЕРЕКИСУ ВОДНЮ ДЛЯ ЛІКУВАННЯ ПАЦІЄНТІВ З ВАРИКОЗНИМ РОЗШИРЕННЯМ ВЕН НИЖНІХ КІНЦІВОК DOI:10.11603/1811-2471.2018.v0.i3.9271
- Mechanochemical endovenous ablation of small saphenous vein insufficiency using the ClariVein device: One-year results of a prospective series / D. Boersma, R. R. J. P. van Eekeren, D. A. B. Werson [et al.] // European Journal of Vascular and Endovascular Surgery. – 2013. – Vol. 45, Issue 3. – P. 299–303.
- Фізика + біохімія: інфекції мультирезистентного золотистого стафілокока вилікують без… ліків(Ваше Здоров'я, 2019)
Джерела
- Фармацевтична хімія: навчальний посібник для студентів хімічних спеціальностей вищих педагогічних навчальних закладів / О.С. Худоярова. – Вінниця: ТОВ «Нілан – ЛТД», 2018.– 194 с. Ел.джерело(С.91-92, 94)
- Аналітична хімія. Хімічні методи аналізу: навчальний посібник/ Л.П.Циганок, Т.О.Бубель, А.Б.Вишнікін, О.Ю.Вашкевич; За ред. проф.Л.П.Циганок - Дніпропетровськ: ДНУ ім. О.Гончара, 2014.- 252 с. Ел.джерело (С.199, 242)
- Водорода пероксид // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Сов. энцикл., 1988. — Т. 1 : Абляционные материалы — Дарзана реакция. — Стб. 779. — Библиогр. в конце ст. — ISBN 5-85270-008-8.(рос.)
- Турова Н. Я. Неорганическая химия в таблицах. / Ред. Григорьев А. Н. — М.: Высший химический колледж РАН, 1997. — 140 с. (рос.) (С. 17)
- Кемпбел Дж. Современная общая химия : [рос.] : в 3 т. / Пер. с англ. под ред. Соколовской Е. М. — М. : Мир, 1975. — Т. 2. — С. 46-47.
Література
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.61, 85)
- Фармакологія: підручник (ВНЗ І—ІІІ р. а.) / І.В. Нековаль, Т.В. Казанюк. — 7-е вид., переробл. і допов. — «Медицина», 2016 — 552 с. ISBN 978-617-505-507-6 (2011 р. - С.57, 76, 468, 481, 489)
- Хімія неметалів з основами біогеохімії. Навчальний посібник для студентів вищих навчальних закладів екологічного та агрономічного профілю /Укл. Мартиненко В.Г., Мартиненко А.П., Медведєва О.В. - Кропивницький: ЦНТУ, 2018.- 330 с. (С.155-156)
Посилання
- ПЕРОКСИД ВОДНЮ //Фармацевтична енциклопедія
- ВОДНЮ ПЕРОКСИДУ РОЗЧИН 30% //Фармацевтична енциклопедія
- Перекис водню. Фізико-хімічні і токсичні властивості (МЕТОДИЧНІ МАТЕРІАЛИ до практичного заняття для студентів 5 курсу медичного факультету з дисципліни «Військова токсикологія, радіологія та медичний захист») 2018
- ПЕРЕКИС ВОДНЮ
- Hydrogen Peroxide Distillation for rocket fuel
- Comparison of ozonation and AOPs combined with biodegradation for removal of THM precursors in treated sewage effluents 1998
- Material Safety Data Sheet
- ATSDR Agency for Toxic Substances and Disease Registry FAQ
- Food Grade Hydrogen Peroxide Information
- Experimental Rocket Propulsion Society
- Hydrogen Peroxide in the NIST Database
- Перекис водню не допомагає вавкам. Три способи його замінити, 2018
- ЗАСТОСУВАННЯ РОЗЧИНІВ ПЕРОКСИДУ ВОДНЮ ДЛЯ ОЧИЩЕННЯ ПОВЕРХНІ ПАМ’ЯТОК АРХІТЕКТУРИ З КАМЕНЮ 2019