Пірокатехол
Пірокатехол (пірокатехін, 1,2-бензендіол) — двоатомний фенол з формулою [1]. Ізомер гідрохінону та резорцину.
| Структурна формула | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
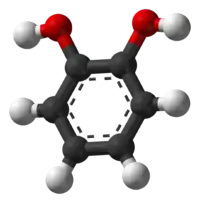 | |||||||||||||
| Загальна інформація | |||||||||||||
| Преференційна назва ІЮПАК | |||||||||||||
| Систематична назва ІЮПАК | бензен-1,2-діол | ||||||||||||
| Інші назви |
Пірокатехін, 1,2-бензолдіол, орто-дигідроксибенен | ||||||||||||
| Хімічна формула | C6H6O2 | ||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | ||||||||||||
| Зовнішні ідентифікатори / Бази даних | |||||||||||||
| |||||||||||||
| Властивості | |||||||||||||
| Молярна маса | 110.036779 грам/моль | ||||||||||||
| Агрегатний стан |
Твердий | ||||||||||||
| Зовнішній вигляд |
Безбарвна тверда речовина | ||||||||||||
| Густина |
1,344 г/см3 (20°C) | ||||||||||||
| Температура плавлення |
105°C | ||||||||||||
| Температура кипіння |
245.5 °C | ||||||||||||
| Розчинність |
4,61 г/л (25°C) | ||||||||||||
| Безпека | |||||||||||||
| Маркування згідно системі УГС
Небезпека | |||||||||||||
| H-фрази | H: H301, H311, H315, H319, H341, H350 | ||||||||||||
| P-фрази | P: P201, P202, P264, P270, P280, P281, P301+P310, P302+P352, P305+P351+P338, P308+P313, P312, P321, P322, P330, P332+P313, P337+P313, P361, P362, P363, P405, P501 | ||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | |||||||||||||
Отримання
Із саліцилового альдегіду
Пірокатехол можна отримати окисненням саліцилальдегіду пероксидом водню у лужному середовищі[1][2]:
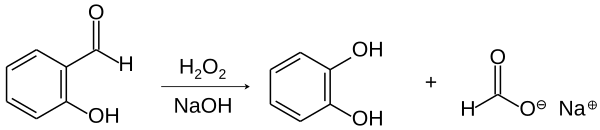
Спочатку альдегід розчиняють у нормальному розчині гідроксиду натрію, далі додають 3% пероксид водню. При цьому суміш нагрівається. Потім розчин стоїть 15-20 годин, а далі додається трохи оцтової кислоти для нейтралізації надлишку лугу. В кінці розчин випарюють на водяній бані[2].
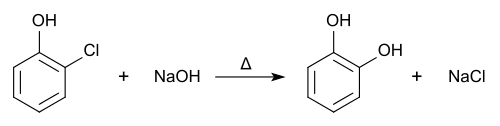
Лужним гідролізом
Пірокатехол можна також отримати лужним гідролізом о-хлорофенолу або о-дихлоробензену[1]:
Фізичні властивості
Є безбарвною твердою речовиною з характерним фенольним запахом[3]. При контакті з повітрям на світлі набуває коричневого кольору[4]. Розчинний у воді[3], спирті, діетиловому етері, бензені, хлороформі, ацетоні та піридині[4].
Хімічні властивості
Кислотні властивості
Проявляє кислотні властивості більше, ніж фенол через взаємний вплив двох OH-груп, може утворювати солі з важкими металами. Наприклад, при додаванні до розчину пірокатехолу ацетату плюбуму випадає білий осад солі пірокатехолу з плюбумом[1][5].
Якісна реакція — поява зеленого забарвлення при додаванні розчину хлориду феруму(III). При додаванні розчину ацетату натрію зелене забарвлення переходить у червоне[5]:
Iron(III)_anion.svg.png.webp)
Алкілювання
Алкілюється також легко, з утворенням етерів. При взаємодії з диіодометаном утворює циклічний етер. Ці реакції проходять у лужному середовищі[5]:
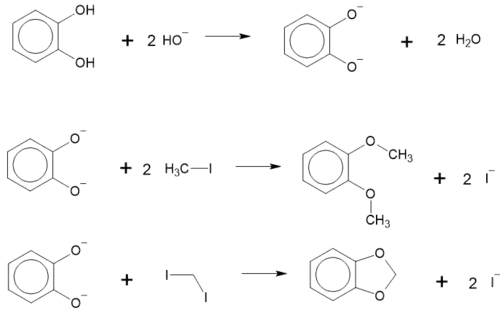
При взаємодії з дигалогеноетерами утворюються краун-етери. Наприклад, взаємодія з дихлороетилового етеру призводить до утворення дибензо-[18]-краун-6[6]:
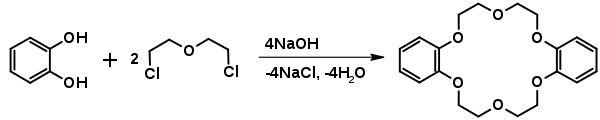
Реакція іде при температурі 100°С у присутності бутанолу. Вихід складає 45%[6].
Взаємодія з фосгеном
При взаємодії пірокатехолу з фосгеном відбувається ацилювання і утворюється о-феніленкарбонат, естер пірокатехолу та карбонатної кислоти. Реакція проходить у лужному середовищі[7]:

Спочатку у колбі, яка заповнена азотом, пірокатехол розчиняють у розчині гідроксиду натрію, далі поступово, при перемішуванні, додають розчин фосгену у толуені, при цьому підтрисується температура від 0 до 5°С. Далі розчин ще годину охолоджують і перемішують. Після того, як розчин нагрівся, його фільтрують. Твердий залишок розчиняють у толуені, а потім толуен відганяють, і продукт починає кристалізуватися[7].
Окиснення
Легко окиснюється до о-бензохінону. Лужні розчини окиснюються ще легше, оскільки при цьому утворюється аніон, який окиснюється легше, ніж сам пірокатехол[1][5][8].
Але серед продуктів окиснення є не тільки бензохінон. Останній може окиснюватися далі з утворенням гетероциклічної сполуки[9]:
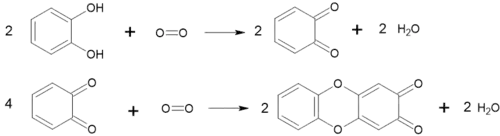
При окисненні може і дециклізуватися з утворенням 2-гідрокси-6-оксогекс-2,4-дієнової кислоти[10]:
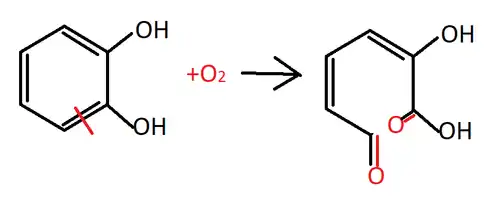
Завдяки цим властивостям пірокатехол, як і гідрохінон, застосовується як відновник у фотографії[1][5].
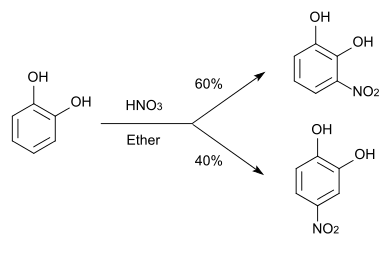
Електрофільне заміщення
Реакції електрофільного заміщення, наприклад, галогенування та нітрування, також протікають легше, ніж в одноатомних фенолів[1][5]:
При ацилюванні пірокатехолу фталевим ангідридом утворюється барвник — алізарин:
.png.webp)
Поширення
Пірокатехол присутній в деяких рослинах, у деревному димі. Деякі продукти також містять пірокатехол. Ще він міститься у складі вугілля та сигаретного диму, може пересуватися крізь грунт[3].
Токсичність
Пірокатехол є токсичною сполукою. Може абсорбуватися через шкіру, викликає дерматит[3]. Спричиняє опіки шкіри та очей[11]. Шкідливий при ковтанні[12]. У великих дозах пошкоджує нирки та печінку[3]. За класифікацією IARC, належить до канцерогенів групи 2B[13].
Також, пірокатехол є токчичним для водних організмів[11].
Примітки
- Ластухін, Юрій Олеквандрович; Воронов, Станіслав Андрійович (2009). Органічна хімія. Львів: Центр Європи. с. 706–708. ISBN 966-7022-19-6.
- CATECHOL. Organic Syntheses 3. 1923. с. 28. doi:10.15227/orgsyn.003.0028. Процитовано 25 вересня 2020.
- PubChem. Catechol. pubchem.ncbi.nlm.nih.gov (англ.). Процитовано 20 вересня 2020.
- Химический энциклопедический словарь (російська). Советская энциклопедия. 1983.
- Нейланд, О.Я. (1990). Органическая химия (російська). Москва: Высшая школа. с. 324–325. ISBN 5-06-001471-1.
- ПРОСТЫЕ ЭФИРЫ. www.chem.msu.su. Процитовано 24 вересня 2020.
- o-PHENYLENE CARBONATE. Organic Syntheses 33. 1953. с. 74. doi:10.15227/orgsyn.033.0074. Процитовано 25 вересня 2020.
- KEGG REACTION: R00058. www.genome.jp. Процитовано 20 вересня 2020.
- KEGG REACTION: R00080. www.genome.jp. Процитовано 21 вересня 2020.
- KEGG REACTION: R00816. www.genome.jp. Процитовано 21 вересня 2020.
- ICSC 0411 - CATECHOL. www.ilo.org. Процитовано 21 вересня 2020.
- CATECHOL | CAMEO Chemicals | NOAA. cameochemicals.noaa.gov. Процитовано 21 вересня 2020.
- OSHA Occupational Chemical Database | Occupational Safety and Health Administration. www.osha.gov. Процитовано 21 вересня 2020.



