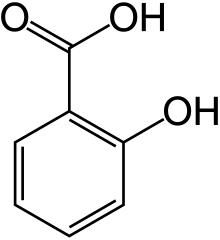
Саліцилова кислота
Саліци́лова кислота (від лат. salix — верба) — безбарвна кристалічна органічна кислота широко використовується в органічному синтезі і функціонує як рослинний гормон. Вона є похідним метаболізму саліцилу. Найвідоміший препарат в лікуванні акне. Синтезована Рафаелем Піріа 1838 року.
| Саліцилова кислота | |
|---|---|
 | |
 | |
| Інші назви | 2-гідроксибензойная кислота |
| Ідентифікатори | |
| Номер CAS | 69-72-7 |
| Номер EINECS | 200-712-3 |
| DrugBank | 00936 |
| KEGG | D00097 і C00805 |
| ChEBI | 16914 |
| RTECS | VO0525000 |
| Код ATC | S01BC08 і D01AE12 |
| SMILES |
C1=CC=C(C(=C1)C(=O)O)O[1] |
| InChI |
InChI=1S/C7H6O3/c8-6-4-2-1-3-5(6)7(9)10/h1-4,8H,(H,9,10) |
| Номер Бельштейна | 774890 |
| Номер Гмеліна | 3418 |
| Властивості | |
| Молекулярна формула | C7H6O3 |
| Молярна маса | 138,12 г/моль |
| Зовнішній вигляд | безкольорові кристали |
| Густина | 1,44 г/см³ |
| Тпл | 159 °C |
| Ткип | 211°C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
Грецький лікар Гіппократ писав у п'ятому столітті до нашої ери про порошок витягнутий з кори верби, який полегшував біль і знижував температуру. Цей засіб також згадується в текстах стародавніх шумерів, Лівану і Ассирії. Черокі та інші корінні американці використовували настій з кори для лікування гарячки та в інших лікувальних цілях протягом століть. Преподобний Едвард Стоун, вікарій із Чіппінг Нортон, Оксфордшир, Англія, в 1763 році відзначив, що кора верби є ефективним засобом у зниженні температури при гарячці.
Активний екстракт з кори, саліцин, був виділений і названий німецьким хіміком Йоганном Андреасом Бюхнером 1826 року. Більша кількість речовини була виділена 1828 року Анрі Леру, французьким фармацевтом. Раффаель Піріу, 1838 року зміг виділити чисту саліцилову кислоту.
Саліцилова кислота також була виділена з трави гадючник в'язолистий німецькими дослідниками 1839 року.
Фізичні властивості
Саліцилова кислота легко розчинна в етанолі, діетиловому ефірі, малорозчинна в сірковуглеці. Розчинність у воді (г/л): 0,8 (0 °C), 1,8 (20 °C), 8,2 (60 °C), 20,5 (80 °C)
Хімічні властивості
Саліцилова кислота має формулу C6H4(OH)COOH, погано розчинна у воді (0,2 г на 100 мл Н2О при 20 °C).
Є двоосновною кислотою: pK1 = 2,7, pK2 = 7,5.
Реакційна здатність бензольного ядра саліцилової кислоти визначається наявністю двох замісників з протилежними мезомерними та індуктивними ефектами: донорної гідроксильної і акцепторної карбоксильної: внаслідок саліцилова кислота значно легше бензойної, але не так активно, як фенол, вступає в реакції електрофільного заміщення внаслідок стабілізації проміжного σ-комплексу гідроксильною групою.
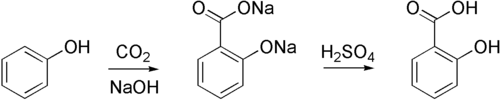
При нагріванні саліцилова кислота декарбоксилюється до фенолу, у промисловості саліцилову кислоту зазвичай отримують зворотною реакцією — карбоксилюванням феноляту натрію вуглекислим газом при 150–180 °C і тиску 5 атм (реакція Кольбе — Шмітта):
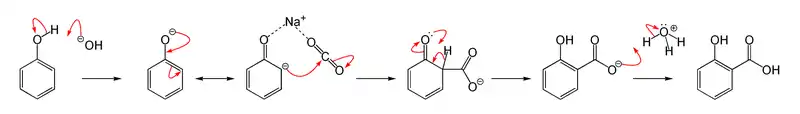
Слід звернути увагу, що таке карбоксилювання фенолу, по-перше оборотне і, по-друге, істотну роль у карбоксилюванні в орто-положення до фенольному гідроксилу грає ефект взаємодії координаційної зв'язку катіона лужного металу з кисневими лігандами з утворенням хелатообразного проміжного стану: так, в орто-положення з утворенням саліцилату карбоксилювання відбувається тільки у випадку фенолятів натрію і літію, у разі фенолятів калію, рубідію і цезію карбоксилювання йде по пара-положенню — катіони цих лужних металів мають більший радіус і координаційна стабілізація перехідного стану неможлива. Про оборотності реакції говорить також перегрупування дікалієвої солі саліцилової кислоти в дікаліевую сіль пара-гідроксібензойной кислоти і перетворення натрієвої солі пара-гідроксібензойной кислоти при нагріванні в динатрієву сіль саліцилової кислоти.
Таке хелатоутворення характерно для саліцилової кислоти. Якісний метод виявлення саліцилової кислоти заснований на утворенні інтенсивно забарвлених у синьо-фіолетовий колір комплексів з хлоридом заліза (III).
Каталітичне гідрування на платині, а також відновлення натрієм в ізоаміловому спирті веде до утворення пімелінової кислоти HOOC(CH2)5COOH.
Токсичність
При потраплянні саліцилової кислоти всередину спостерігається подразнення слизової оболонки шлунку, з'являється біль у надчеревній ділянці, нудота, а іноді й блювота. Тому саліцилову кислоту не вживають перорально — з цією метою використовують солі саліцилової кислоти (саліцилати) та її похідні[2].
Рослинний гормон
Саліцилова кислота (СК) є фенольним фітогормоном і знаходиться в рослинах впливаючи на ріст і розвиток рослин, фотосинтез, транспірацію, поглинання іонів та транспорт всередині рослини. СК також викликає специфічні зміни в анатомії листя і хлоропластових структур.

Виробництво
Саліцилова кислота синтезуються з амінокислоти фенілаланіну. З Arabidopsis thaliana вона також може бути синтезована за допомогою фенілаланін-незалежного шляху. Натрію саліцилат оброблюють натрієм фенолятом (натрієва сіль фенолу) з діоксидом вуглецю при високому тиску (100 атм) і при високій температурі (390K) — метод, відомий як реакція Кольбе — Шмітта. Окислення продукту з сірчаною кислотою дає саліцилову кислоту:
Вона також може бути отримана гідролізом аспірину (ацетилсаліцилова кислота) або метилсаліцилату з сильною кислотою або основою.
Інші сфери використання
Хоча саліцилова кислота токсична у великих кількостях, та все ж вона використовується як харчовий консервант. У деяких людей проявляється підвищена чутливість до саліцилатів, тому навіть малі дози речовин можуть бути шкідливі.
У концентраціях 10-20% саліцилова кислота виявляє кератопластичну дію (розпушує і відокремлює епідерміс) - це обумовлює її використання в складі протимозольних засобів. У концентраціях 1-2% сприяє розростанню епідермісу.
Медицина
Спиртовий розчин саліцилової кислоти (1 %, 2 %) застосовують як дерматологічний, антисептичний засоби[3]
Див. також
Примітки
- salicylic acid
- І.М.Трахтенберг - Книга про отрути та отруєння. Нариси токсикології.
- Саліцилової кислоти розчин спиртовий
Література
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.238-240,249,264,299)
- I. Raskin Role of Salicylic Acid in Plants. Annual Review of Plant Physiology and Plant Molecular Biology, June 1992, Vol. 43, Pages 439–463 (англ.)
- Курц А Л., Ливанцов М. В., Ливанцова Л. И. Фенолы и хиноны. (рос.)
- В. Ф. Крамаренко. Токсикологическая химия. (рос.) (С.?)