Трифлуороцтова кислота
Трифлуорóцтова кислота — це галогенкарбонова кислота з хімічною формулою . Це безбарвна димуча рідина з різким запахом, добре розчинна у воді[1] та органічних розчинниках [2].

| Трифлуороцтова кислота | |
|---|---|
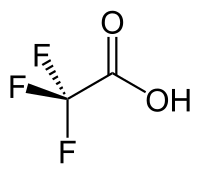 Структурна формула | |
 Ампула з трифлуороцтовою кислотою | |
| Назва за IUPAC | 2,2,2-трифлуоретанова кислота |
| Ідентифікатори | |
| Номер CAS | 76-05-1[1] |
| Номер EINECS | 200-929-3 |
| Номер EC | 200-929-3[1] |
| ChEBI | 45892 |
| RTECS | AJ9625000[1] |
| SMILES |
C(=O)(C(F)(F)F)O[1] |
| InChI |
1S/C2HF3O2/c3-2(4,5)1(6)7/h(H,6,7)[1] |
| Номер Бельштейна | 742035 |
| Номер Гмеліна | 2729 |
| Властивості | |
| Молекулярна формула | F3CCOOH[1] |
| Молярна маса | 113,992864 г/моль[1] |
| Молекулярна маса | 114,02 а.о.м.[1] |
| Зовнішній вигляд | безбарвна димуча рідина[1] |
| Тпл | -15,2°C[1] |
| Ткип | 72-73°C[1] |
| Розчинність (вода) | 100 г/100 мл (20°C)[1] |
| Розчинність ([[ацетон, діетиловий етер, етанол]]) | необмежено[2] |
| Тиск насиченої пари | 11 кПа (20°C)[1] |
| Кислотність (pKa) | 0,3[1] |
| Небезпеки | |
| ЛД50 | 1200 мг/кг (миші, внутрішньовенно)[1] |
| ГГС піктограми | 
|
| ГГС формулювання небезпек | H314, H332, H412 |
| ГГС запобіжних заходів | P260, P261, P264, P271, P273, P280, P301+P330+P331, P303+P363+P351
,P304+P312, P304+P340, P305+P351+P338, P310, P312, P321, P363, P405 ,P501[1] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Отримання
У промисловості трифлуороцтову кислоту одержують флуоруванням оцтової кислоти в рідкому флуороводні при електролізі[3]:
з подальшим гідролізом утворюваного флуорангідриду:
Також трифлуороцтову кислоту можна отримати заміщенням хлору або брому на флуор[3]:
Хімічні властивості
Трифлуороцтова кислота є сильною кислотою, найсильнішою з галогенокарбонових[3]. Це пов'язано з тим, що флуор має найвищу електронегативність, отже, трифлуорометильний замісник виявляє дуже сильний -I-ефект.
При нагріванні трифлуороцтова кислота здатна до декарбоксилювання з утворенням трифлуорметану та вуглекислого газу:
Застосування
Сировина для синтезу флуоровмісних органічних сполук. Зручний реагент в органічному синтезі внаслідок комбінації властивостей: леткість, розчинність в органічних розчинниках, сила кислоти; зокрема, застосовується як каталізатор в реакціях естерифікації та полімеризації.[2] Розчинник в ЯМР-дослідженні кислотостійких речовин.
Примітки
- Trifluoroacetic acid | CF3COOH - PubChem. pubchem.ncbi.nlm.nih.gov (англійська).
- Трифторуксусная кислота // Химическая энциклопедия : в 5 т. / гл. ред. Н. С. Зефиров. — М. : Большая Рос. энцикл., 1998. — Т. 5 : Триптофан — Ятрохимия. — Стб. 9. — Библиогр. в конце ст. — ISBN 5-85270-310-9.(рос.)
- Ластухін, Юрій Олександрович; Воронов, Станіслав Андрійович (2009). Органічна хімія. Львів: Центр Європи. с. 452–456. ISBN 966-7022-19-6.
