Оксид фосфору(III)
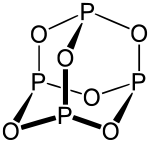
Окси́д фо́сфору(III), фо́сфор(III) окси́д — неорганічна сполука складу P4O6 (також записується P2O3). За звичайних умов є білими, плавкими кристалами із різким запахом. Самозаймається за незначної температури і має токсичні властивості.
| Оксид фосфору(III) | |
|---|---|
 | |
| Інші назви | триоксид фосфору, фосфітний ангідрид |
| Ідентифікатори | |
| Номер CAS | 12440-00-5 |
| Номер EINECS | 235-670-5 |
| ChEBI | 37372 |
| SMILES |
O1P2OP3OP1OP(O2)O3[1] |
| InChI |
InChI=1S/O6P4/c1-7-2-9-4-8(1)5-10(3-7)6-9 |
| Номер Гмеліна | 26856 |
| Властивості | |
| Молекулярна формула | P4O6 (також P2O3) |
| Молярна маса | 219,891 г/моль (P4O6) 109,946 г/моль (P2O3) |
| Зовнішній вигляд | білі кристали |
| Густина | 2,135 г/см³ |
| Тпл | 23,8 °C |
| Ткип | 175,3 °C |
| Розчинність (вода) | 1,7 г/100 г H2O |
| Небезпеки | |
| Температура самозаймання | 70 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Сполука є ангідридом фосфітної кислоти, із лугами утворює ряд фосфітів.
Промислового значення оксид фосфору не має.
Фізичні властивості
Оксид фосфору(III) є м'якими кристалами білого кольору. Речовина має різкий запах і вкрай токсична. Самозаймається при температурі 70 °C, а при наявності значного вмісту домішки білого фосфору самозаймання може відбутися навіть за кімнатної температури.
Слабко розчиняється у воді і добре — в органічних розчинниках (бензені, тетрахлорометані, хлороформі, сірковуглеці).
Отримання
Оксид фосфору(III) можна синтезувати при спалюванні білого фосфору в атмосфері з обмеженою кількості кисню (75% кисню, 25% азоту) при 90 мм рт. ст.:
Вихід синтезу становить близько 50—60%. Утворений оксид завжди матиме домішку білого фосфору, який можна перевести у червоний фосфор шляхом дії на нього ультрафіолетового випромінювання, що суттєво полегшує подальше очищення.
Менш поширеними методами є окиснення фосфору оксидами N2O та CO2, відновлення оксиду P4O10 білим фосфором:
Хімічні властивості
За кімнатної температури оксид фосфору(III) поступово окиснюється до оксиду фосфору(V):
При нагріванні до 200—400 °C у герметичній камері оксид P4O6 диспропорціонує із утворенням червоного фосфору та суміші оксидів загального складу P4Ox (x = 7—9).
Оксид P4O6 є кислотним оксидом: гідролізуючись у воді, він утворює фосфітну кислоту, а з лугами — відповідні фосфіти:
При розчиненні у гарячій воді сполука диспропорціонує на ортофосфатну кислоту, фосфін і червоний фосфор:
Оксид фосфору взаємодіє з деякими неметалами: з хлором, бромом, йодом і сіркою:
Реагуючи із газуватим хлороводнем, диспропорціонує на фосфітну кислоту і трихлорид фосфору:
P4O6 може виступати як ліганд, наприклад, заміщуючи ліганди у карбонілах металів:
Джерела
- Greenwood N. N., Earnshaw A. Chemistry of the Elements. — 2nd. — Oxford : Butterworth-Heinemann, 1997. — P. 503-505. — ISBN 0-7506-3365-4. (англ.)
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Fee D. C., Gard D. R., Yang C. Phosphorus compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 18. — P. 373. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Bettermann G. Phosphorus Compounds, Inorganic // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 3-4. — DOI: (англ.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Tetraphosphorus hexaoxide
