Трихлоретилен
Трихлороетилен — це хімічна сполука (C2HCl3), що відноситься до класу хлорованих вуглеводнів і широко використовується в промисловості як розчинник. За своїми фізичними характеристиками трихлоретилен є безбарвною негорючою рідиною з солодкувати запахом. За номенклатурою IUPAC назва сполуки — трихлоретен. Абревіатури, які часто використовуються в промисловості: ТХЕ, трихлор. Під торговою маркою Трімар та Трилен, трихлороетилен використовується як інгаляційний анестетик та анальгетик.
| Трихлоретилен | |
|---|---|
 | |
 {{{ImageAltL2}}} |
 |
| Назва за IUPAC | трихлоретилен |
| Інші назви | 1,1,2-трихлоретилен, 1,1-дихлоро-2-хлоретилен, 1-хлоро-2,2-дихлороетилен, ацетилен трихлорид, ТХЕ, Трімар, Трилен |
| Ідентифікатори | |
| Абревіатури | ТХЕ |
| Номер CAS | 79-01-6 |
| PubChem | 6575 |
| Номер EINECS | 201-61-04 |
| DrugBank | 13323 |
| KEGG | C06790 |
| Назва MeSH | D02.455.526.439.939 |
| ChEBI | 16602 |
| RTECS | KX4550000 |
| Код ATC | N01AB05 |
| SMILES |
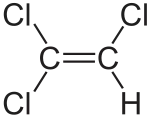
ClC=C(Cl)Cl |
| InChI |
1/C2HCl3/c3-1-2(4)5/h1H |
| Номер Бельштейна | 1736782 |
| Номер Гмеліна | 184631 |
| Властивості | |
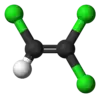
| Молекулярна формула | C2HCl3 |
| Молярна маса | 131,39 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 1.463 г/см3 (25 °C) |
| Тпл | −84.8 °C |
| Розчинність (вода) | 1.280 г/літр |
| Розчинність | діетиловий етер, етанол, хлороформ |
| Показник заломлення (nD) | 1.4777 at 19.8 °C |
| Небезпеки | |
| Головні небезпеки | Шкідливо при ковтанні або вдиханні |
| NFPA 704 |
 1
2
0
|
| Пов'язані речовини | |
| Пов'язані речовини | хлороформ 1,1,1-трихлоретан 1,1,2-трихлоретан |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
Першою почала виробляти трихлороетилен британська компанія Імперія Хімічної Промисловості, що опісля вилилося у так звану революцію анестетиків. Спочатку вважали, що трихлороетилен є кращим анестетиком, оскільки має меншу гепатоксичність у порівнянні з хлороформом. Більше того, ТХЕ на противагу діетиловому етерy, який широко використовувався на той час, не є легкозаймистим. Але згодом було встановлено цілу низку побічних ефектів, що можуть бути викликані дією трихлороетилену. Це, в першу чергу порушення серцевої аритмії. Також була доведена гепатоксичніть ТХЕ. Відкриття галотану в 1956 році сприяло зменшенню використання ТХЕ як загального анестетика. Незважаючи на це ТХЕ, ще тривалий час використовувався як інгаляційний анальгетик при пологах. Висока токсичність для плоду та побоювання щодо високого канцерогенного потенціалу ТХЕ призвели до того, що даний препарат був повністю заборонений в 1980-ті роки в більшості розвинених країн світу. Через побоювання стосовно токсичності, використання трихлоретилену в харчовій та фармацевтичній промисловостях було заборонено починаючи з 1970 року майже у всьомі світі. Законодавство змусило замінити трихлоретилен в більшості хімічних виробництв Європи, оскільки він був класифікований як канцероген, що може викликати рак. Фаза ризику для трихлоретилен була встановлена під індексом R45. Забруднення підземних вод ТХЕ стало важливою екологічною проблемою людства. У 2005 році Управлінням з охорони навколишнього середовища США (USEPA) були оприлюднені результати, щодо остаточної оцінки впливу трихлоретилена на здоров'я людини. Результати досліджень формально характеризували трихлоретилен як людський канцероген, що одночасно характеризується і негативним не канцерогенним характером впливу на здоров'я людини. У 2011 році токсикологічний огляд USЕРА відніс трихлоретилен до списку встановлених канцерогенів.[1]
Виробництво
До початку 1970-х років майже весь трихлоретилен отримували двостадійним синтезом з ацетилену. На першій стадії ацетилен вступав в реакцію з хлором у присутності каталізатора (хлориду заліза) при температурі 90 °C, що призводило до утворення 1,1,2,2-тетрахлоретану
На другій стадії відбувалася стадія дегідрохлорування, що вело до утворення трихлоретилену. Така реакція може відбуватися під дією водного розчину гідроксиду кальцію
або у газовій фазі при нагріванні до 300–500 °C у присутності хлориду барію або хлориду кальцію як каталізатора: Cl2CHCHCl2 → ClCH=CCl2 + HCl
Сьогодні тирхлоретилен отримують, переважно, з етилену. Спочатку, етилен хлорують у присутності каталізатора (хлориду заліза) з утворенням 1,2-дихлоретилену
- CH2=CH2 + Cl2 → ClCH2CH2Cl
Якщо здійснити додаткове нагрівання дихлоретилену до 400 °C у присутності надлишку хлору утворюється трихлоретилен: ClCH2CH2Cl + 2 Cl2 → ClCH=CCl2 + 3 HCl
Остання трансформаці може бути каталізована різними сполуками. Найбільш широко застосовується як каталізатор суміш хлориду калію та хлориду алюмінію. Різні форми активованого вугілля також можуть слугувати каталізаторами. У результаті останньої реакції часто утворюється тетрахлоретилен як побічний продукт, вміст якого залежить головним чином від кількості хлору, який використовується при перетворенні. За певних умов саме тетрахлоретилен може бути головним продуктом реакції. Суміш тетрахлоетилену та трихлоретилену розділяють за допомогою перегонки.
Використання
Трихлоретилен є ефективним розчинником для багатьох хімічних сполук. Після налагодження промислового виробництва трихлоретилену в 1920-х його почали широко використовувати як розчинник для екстракцї соєвих, кокосових та пальмових олій. Крім того, трихлоретилен застосовувався для декофеїнізації кави та отримання смакових екстрактів з хмелю та прянощів. Трихлоретилен також використовувався при отриманні 100% етанолу для видалення з нього залишкових кількостей води.
У період з 1930-1970-х років, як у Північній Америці так і в Європі, трихлоетилен використовувався як інгаляційний анестетик, здебільшого, у суміші з оксидом азоту (I). У Великій Британії трихлоретилен продавався під торговою маркою «Трилен» і був забарвлений (барвник «Унісол», CAS:14233-37-5) у блакитний колір, аби уникнути плутанини з подібним хлороформом. Трихлоретилен витіснив раніше вживані анестетики, такі як хлороформ та діетиловий етер в 1940-вих роках. Однак у 1960-х роках ТХЕ був повністю замінений на галотан, який був більш ефективним. «Трилен» використовувався як інгаляційний анальгетик під час пологів. Слід відмітити, що трихлоретилен у 2000-х роках продовжували використовувати як анестетик у країнах Африки.[2]
Тривалий час трихлоретилен використовувався як розчинник для очищення одягу в хімчистках, проте був повністю замінений на тетрахлоретилен (перхлоретилен) в 1950-х роках (подекуди використовувався у деяких процесах виведення плям аж до 2000 року).
Трихлоретилен використовувався в автоматичних машинах для очищення кіноплівки аж до 2009 року, а також під час ручного очищення кіноплівки за допомогою безворсових серветок.
Ймовірно, найпоширеніше використання трихлоретилен знайшов як розчинник для знежирення металевих поверхонь. Попит на трихлоретилен як на знежирювач почав різко зменшуватися в 1950-ті роки через винайдення менш токсичного 1,1,1-трихлоретану. Але слід зазначити, що виробництво 1,1,1-трихлоретану було припинено у більшості країн світу відповідно до умов Монреальського протоколу, що дало можливість трихлоретилену відновити втрачені позиції на ринку розчинників для знежирювання.
Трихлоретилен використовувався у Сполучених Штатах Америки для очищення гасових ракетних двигунів (проте не використовувався для очищення водневих ракетних двигунів, таких як, рекетний двигун транспорної системи «Спейс Шаттл»). Після циклу роботи ракетного двигуна, який працює з використанням гасу високого ступеня очищення (RP-1, Rocket Propellant) у паливно-ракетній системі залишається значна залишкова кількість вуглеводнів та їх парів. Всі ці вуглеводневі домішки обов'язково мають бути видалені з ракетної системи двигуна для уникнення можливого вибуху під час майбутнього запуску двигуна. Саме трихлоретилен і використовували для очищення паливної системи двигуна безпосередньо після кожного пробного запуску ракетного двигуна. Процедура очищення полягає у повному наповненні трихлоретиленом паливної ракетної системи на період від кількох секунд до 30—35 хвилин залежно від типу двигуна.[3][4] Для деяких типів ракетних систем трихлоретилен використовувався для очищення паливного генератора та куполу подачі рідкого кисню.[4]
Трихлоретилен також використовується для виробництва фторовмісних охолоджуючих агентів[5], наприклад, 1,1,1,2-тетрафторетану, що більш відомий під абревіатурою HFC 134a.
Хімічна нестабільність
Незважаючи на широке застосування як знежирювача металевих поверхонь, трихлоретилен є нестійким у присутності металу при тривалій їх взаємодії. Напочатку 1961 року цей феномен був остаточно встановлений і трихлоретилен почали продавати зі стабілізуючими добавками. Так як нестабільність трихлоретилену зростала з підвищенням температури, пошук стабілізаторів проводився шляхом його нагрівання до температури кипіння зі зворотнім холодильником та спостереження процесу розкладу. Першим широко вживаним стабілізатором став діоксан, проте його застосування було запатентовано Dow Chemical Company, що значно обмежувало його широке використання у такому складі. Значні дослідження були проведені у 1960-х роках, що дало можливість знайти кілька альтернативних стабілізаторів трихлоретилену. Одним з таких стабілізаторів були кетони, наприклад, метилетил кетон.
Примітки
- United States Environmental Protection Agency (September 2011). EPA 635 (R–09/011F) http://www.epa.gov/iris/toxreviews/0199tr/0199tr.pdf Пропущений або порожній
|title=(довідка). - P. Fenton (2000). Volatile Anaesthetic Agents. Архів оригіналу за 7 січня 2012. Процитовано 11 лютого 2012.
- The Use of Trichloroethylene at NASA's SSFL Sites. Архів оригіналу за 14 листопада 2013. Процитовано 1 квітня 2014.
- F-1 Rocket Engine Operating Instructions
- http://www.nd.edu/~enviro/design/r134a.pdf
Джерела та література
- Doherty, Richard E. (2000). A History of the Production and Use of Carbon Tetrachloride, Tetrachloroethylene, Trichloroethylene and 1,1,1-Trichloroethane in the United States: Part 2--Trichloroethylene and 1,1,1-Trichloroethane. Environmental Forensics 1 (2): 83–93. doi:10.1006/enfo.2000.0011.
Посилання
- Трихлоретилен // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
