Тіонілхлорид
Тіонілхлорид (хлористий тіоніл) SOCl2 — хлорангідрид сірчистої кислоти. Належить до тіонілгалогенідів.
| Тіонілхлорид | |
|---|---|
 | |
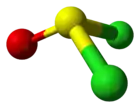 Кульково-стрижнева модель молекули тіонілхлориду | |
 | |
| Назва за IUPAC | Сірчистий дихлорид |
| Інші назви |
|
| Ідентифікатори | |
| Номер CAS | 7719-09-7 |
| PubChem | 24386 |
| Номер EINECS | 231-748-8 |
| ChEBI | 29290 |
| RTECS | XM5150000 |
| SMILES |
ClS(Cl)=O |
| InChI |
1/Cl2OS/c1-4(2)3 |
| Номер Бельштейна | 1209273 |
| Властивості | |
| Молекулярна формула | SOCl2 |
| Молярна маса | 118,97 г/моль |
| Зовнішній вигляд | безколірна рідина (з часом жовтіє) |
| Запах | гострий і неприємний |
| Густина | 1,638 г/см3, рідина |
| Тпл | −104,5 |
| Розчинність (вода) | активний |
| Розчинність | розчинний у більшості апротонних розчинників: толуен, хлороформ, діетиловий етер. Реагує з протонними розчинниками, такими як спирти |
| Тиск насиченої пари |
|
| Показник заломлення (nD) | 1,517 (20 °C)[2] |
| В'язкість | 0,6 сП |
| Структура | |
| Геометрія | пірамідальна |
| Дипольний момент | 1,44 Д |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
−245,6 кДж/моль (рідина)[3] |
| Ст. ентропія S |
309,8 кДж/моль (газ)[3] |
| Теплоємність, c |
121,0 Дж/моль (рідина)[3] |
| Небезпеки | |
| ГДК (США) | немає[4] |
| ГГС піктограми |    |
| ГГС формулювання небезпек | 302, 314, 331 |
| ГГС запобіжних заходів | 261, 280, 305+351+338, 310 |
| Головні небезпеки |
|
| NFPA 704 |
 0
4
2
|
| Температура спалаху | негорючий |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Властивості
Тіонілхлорид — безбарвна димна на повітрі рідина з задушливим запахом. Молекула тіонілхлориду має пірамідальну будову.
При нагріванні вище від температури кипіння тіонілхлорид починає розкладатися з утворенням S2Cl2, SO2, Cl2. Вище від 440 °C спостерігається повний розпад сполуки.
У воді розкладається на діоксид сірки і хлороводень:
Широко застосовується в органічному синтезі як хлорувальний агент, наприклад, для отримання хлорангідридів карбонових кислот і алкілгалогенідів:
Отримання
Тіонілхлорид можна отримати за такими реакціями:
У промисловості тіонілхлорид отримують прямою взаємодією сірки, кисню, хлору за 180—200 °C (з використанням як каталізатора активованого вугілля) або дією надлишку діоксиду сірки на тетрахлорметан у присутності хлориду алюмінію за 150 °C і тиску близько 4 МПа (40 кгс/см2).
Застосування

Застосовують у виробництві барвників, фармацевтичних препаратів, графену, для хлорування.
Реакція кодеїну з тіонілхлоридом і подальшим каталітичним відновленням і деметилюванням використовується для отримання дезоморфіну.
Літійтіонілхлоридні батарейки
Застосовують як додатний електрод в одноразових літієвих хімічних джерелах струму, так званих літійтіонілхлоридних батарейках. Негативний електрод літієвий. Хімічний процес у батареї:
Напруга нової батареї 3,65 В, закінчення розряду — 3,0 В. Характеристика розряду плоска з різким падінням напруги в кінці ємності.
Ці батарейки відрізняються високою густиною енергії (0,5 кВт*год/кг, 1,2 кВт*год/л), тривалими термінами роботи (понад 20 років, саморозряд ~1 %/рік) і широким температурним діапазоном (до -80..+130 °C).[5] Однак їх використання обмежене професійними застосуваннями через токсичність вмісту і ризик вибухового руйнування при короткому замиканні.
Батареї цього типу мають схильність до пасивації — осадження плівки хлориду літію на літієвому електроді за тривалої відсутності навантаження або малих струмів споживання. При цьому внутрішній опір батареї значно зростає. При навантаженні батарея через деякий час відновлює характеристики.[6]
Небезпека
Небезпека для здоров'я
Токсичний, подразнює і роз'їдає слизові оболонки, викликаючи важкі опіки[7]. За нормальних умов тіонілхлорид легко випаровується (парціальний тиск пари 16 кПа). Його пара має дуже сильну подразнювальну дію при контакті зі шкірою, очима та слизовими оболонками. Вдихання пари тіонілхлориду може викликати набряк легенів. Надмірний вплив може призвести до появи симптомів нефіброзного пошкодження легенів. Внаслідок дії речовини можливі загострення астми та інших респіраторних захворювань, шкірної алергії, екземи. За контакту з речовиною місце контакту слід промити великою кількістю води. Пара тіонілхлориду важче від повітря.
При потраплянні в ШКТ або легені речовина активно всмоктується в організм. Летальна концентрація (LC50) для щура 500 ppm при вдиханні парів протягом 1 години. За потрапляння в ШКТ забороняється викликати блювоту водою.
У США граничний пороговий рівень одноразового впливу за OSHA і ACGIH 1,0 ppm (5,0 мг/м3) (2001 рік).
Хімічна небезпека
Речовина розкладається за розігріву понад 140 °C з утворенням токсичних та їдких димів. Бурхливо реагує з водою, утворюючи токсичну пару діоксиду сірки і хлорводню. Реагує з небезпекою пожежі і вибуху з багатьма речовинами, наприклад, амінами, основами і металами.
Речовина входить до Списку 3 Конвенції про заборону хімічної зброї як прекурсор деяких бойових нервово-паралітичних отруйних речовин.
Пожежна небезпека
Не горючий, але багато реакцій можуть призвести до пожежі або вибуху. За температур вище 140 °C (зокрема у вогні) виділяються подразнювальні або токсичні пари і гази. Забороняється застосування води при гасінні пожежі якщо поруч є тіонілхлорид. Допускається застосування порошкових та вуглекислотних засобів гасіння.
Примітки
- Шаблон:Nist
- Patnaik, Pradyot (2003). Handbook of Inorganic Chemicals. New York, NY: McGraw-Hill. ISBN 0-07-049439-8.
- Lide, David R., ред. (1996). CRC Handbook of Chemistry and Physics (вид. 76th). Boca Raton, FL: CRC Press. с. 5–10. ISBN 0-8493-0476-8.
- Thionyl chloride
- All About Batteries, Part 7: Lithium Thionyl Chloride
- Особенности работы литий-тионилхлоридных батарей
- ТИОНИЛХЛОРИД
Література
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др. — М. : Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
