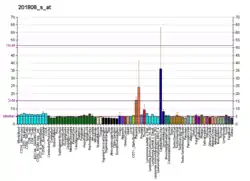
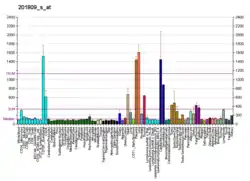
ENG
ENG (англ. Endoglin) – білок, який кодується однойменним геном, розташованим у людей на короткому плечі 9-ї хромосоми.[4] Довжина поліпептидного ланцюга білка становить 658 амінокислот, а молекулярна маса — 70 578[5].
Послідовність амінокислот
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MDRGTLPLAV | ALLLASCSLS | PTSLAETVHC | DLQPVGPERG | EVTYTTSQVS | ||||
| KGCVAQAPNA | ILEVHVLFLE | FPTGPSQLEL | TLQASKQNGT | WPREVLLVLS | ||||
| VNSSVFLHLQ | ALGIPLHLAY | NSSLVTFQEP | PGVNTTELPS | FPKTQILEWA | ||||
| AERGPITSAA | ELNDPQSILL | RLGQAQGSLS | FCMLEASQDM | GRTLEWRPRT | ||||
| PALVRGCHLE | GVAGHKEAHI | LRVLPGHSAG | PRTVTVKVEL | SCAPGDLDAV | ||||
| LILQGPPYVS | WLIDANHNMQ | IWTTGEYSFK | IFPEKNIRGF | KLPDTPQGLL | ||||
| GEARMLNASI | VASFVELPLA | SIVSLHASSC | GGRLQTSPAP | IQTTPPKDTC | ||||
| SPELLMSLIQ | TKCADDAMTL | VLKKELVAHL | KCTITGLTFW | DPSCEAEDRG | ||||
| DKFVLRSAYS | SCGMQVSASM | ISNEAVVNIL | SSSSPQRKKV | HCLNMDSLSF | ||||
| QLGLYLSPHF | LQASNTIEPG | QQSFVQVRVS | PSVSEFLLQL | DSCHLDLGPE | ||||
| GGTVELIQGR | AAKGNCVSLL | SPSPEGDPRF | SFLLHFYTVP | IPKTGTLSCT | ||||
| VALRPKTGSQ | DQEVHRTVFM | RLNIISPDLS | GCTSKGLVLP | AVLGITFGAF | ||||
| LIGALLTAAL | WYIYSHTRSP | SKREPVVAVA | APASSESSST | NHSIGSTQST | ||||
| PCSTSSMA |
Кодований геном білок за функцією належить до фосфопротеїнів. Задіяний у таких біологічних процесах, як клітинна адгезія, ангіогенез, альтернативний сплайсинг. Локалізований у мембрані.
Література
- Lee N.Y., Blobe G.C. (2007). The interaction of endoglin with beta-arrestin2 regulates transforming growth factor-beta-mediated ERK activation and migration in endothelial cells.. J. Biol. Chem. 282: 21507 — 21517. PubMed DOI:10.1074/jbc.M700176200
- Shovlin C.L., Hughes J.M.B., Scott J., Seidman C.E., Seidman J.G. (1997). Characterization of endoglin and identification of novel mutations in hereditary hemorrhagic telangiectasia.. Am. J. Hum. Genet. 61: 68 — 79. PubMed DOI:10.1086/513906
- Pece-Barbara N., Cymerman U., Vera S., Marchuk D.A., Letarte M. (1999). Expression analysis of four endoglin missense mutations suggests that haploinsufficiency is the predominant mechanism for hereditary hemorrhagic telangiectasia type 1.. Hum. Mol. Genet. 8: 2171 — 2181. PubMed DOI:10.1093/hmg/8.12.2171
- Bossler A.D., Richards J., George C., Godmilow L., Ganguly A. (2006). Novel mutations in ENG and ACVRL1 identified in a series of 200 individuals undergoing clinical genetic testing for hereditary hemorrhagic telangiectasia (HHT): correlation of genotype with phenotype.. Hum. Mutat. 27: 667 — 675. PubMed DOI:10.1002/humu.20342
- Richards-Yutz J., Grant K., Chao E.C., Walther S.E., Ganguly A. (2010). Update on molecular diagnosis of hereditary hemorrhagic telangiectasia.. Hum. Genet. 128: 61 — 77. PubMed DOI:10.1007/s00439-010-0825-4
- Gougos A., Letarte M. (1990). Primary structure of endoglin, an RGD-containing glycoprotein of human endothelial cells.. J. Biol. Chem. 265: 8361 — 8364. PubMed
Примітки
- Захворювання, генетично пов'язані з ENG переглянути/редагувати посилання на ВікіДаних.
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:3349 (англ.). Процитовано 7 вересня 2017.
- UniProt, P17813 (англ.). Процитовано 7 вересня 2017.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.