HSP90B1
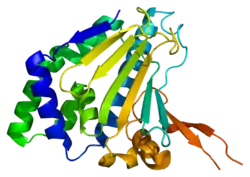
HSP90B1 (англ. Heat shock protein 90 beta family member 1) – білок, який кодується однойменним геном, розташованим у людей на короткому плечі 12-ї хромосоми. [3] Довжина поліпептидного ланцюга білка становить 803 амінокислот, а молекулярна маса — 92 469[4].
Послідовність амінокислот
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MRALWVLGLC | CVLLTFGSVR | ADDEVDVDGT | VEEDLGKSRE | GSRTDDEVVQ | ||||
| REEEAIQLDG | LNASQIRELR | EKSEKFAFQA | EVNRMMKLII | NSLYKNKEIF | ||||
| LRELISNASD | ALDKIRLISL | TDENALSGNE | ELTVKIKCDK | EKNLLHVTDT | ||||
| GVGMTREELV | KNLGTIAKSG | TSEFLNKMTE | AQEDGQSTSE | LIGQFGVGFY | ||||
| SAFLVADKVI | VTSKHNNDTQ | HIWESDSNEF | SVIADPRGNT | LGRGTTITLV | ||||
| LKEEASDYLE | LDTIKNLVKK | YSQFINFPIY | VWSSKTETVE | EPMEEEEAAK | ||||
| EEKEESDDEA | AVEEEEEEKK | PKTKKVEKTV | WDWELMNDIK | PIWQRPSKEV | ||||
| EEDEYKAFYK | SFSKESDDPM | AYIHFTAEGE | VTFKSILFVP | TSAPRGLFDE | ||||
| YGSKKSDYIK | LYVRRVFITD | DFHDMMPKYL | NFVKGVVDSD | DLPLNVSRET | ||||
| LQQHKLLKVI | RKKLVRKTLD | MIKKIADDKY | NDTFWKEFGT | NIKLGVIEDH | ||||
| SNRTRLAKLL | RFQSSHHPTD | ITSLDQYVER | MKEKQDKIYF | MAGSSRKEAE | ||||
| SSPFVERLLK | KGYEVIYLTE | PVDEYCIQAL | PEFDGKRFQN | VAKEGVKFDE | ||||
| SEKTKESREA | VEKEFEPLLN | WMKDKALKDK | IEKAVVSQRL | TESPCALVAS | ||||
| QYGWSGNMER | IMKAQAYQTG | KDISTNYYAS | QKKTFEINPR | HPLIRDMLRR | ||||
| IKEDEDDKTV | LDLAVVLFET | ATLRSGYLLP | DTKAYGDRIE | RMLRLSLNID | ||||
| PDAKVEEEPE | EEPEETAEDT | TEDTEQDEDE | EMDVGTDEEE | ETAKESTAEK | ||||
| DEL |
Кодований геном білок за функцією належить до шаперонів. Білок має сайт для зв'язування з АТФ, нуклеотидами, іоном кальцію. Локалізований у ендоплазматичному ретикулумі.
Література
- Maki R.G., Old L.J., Srivastava P.K. (1990). Human homologue of murine tumor rejection antigen gp96: 5'-regulatory and coding regions and relationship to stress-induced proteins.. Proc. Natl. Acad. Sci. U.S.A. 87: 5658 — 5662. PubMed DOI:10.1073/pnas.87.15.5658
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Chang S.C., Erwin A.E., Lee A.S. (1989). Glucose-regulated protein (GRP94 and GRP78) genes share common regulatory domains and are coordinately regulated by common trans-acting factors.. Mol. Cell. Biol. 9: 2153 — 2162. PubMed DOI:10.1128/MCB.9.5.2153
- Meunier L., Usherwood Y.-K., Chung K.T., Hendershot L.M. (2002). A subset of chaperones and folding enzymes form multiprotein complexes in endoplasmic reticulum to bind nascent proteins.. Mol. Biol. Cell 13: 4456 — 4469. PubMed DOI:10.1091/mbc.E02-05-0311
- Zhang H., Li X.-J., Martin D.B., Aebersold R. (2003). Identification and quantification of N-linked glycoproteins using hydrazide chemistry, stable isotope labeling and mass spectrometry.. Nat. Biotechnol. 21: 660 — 666. PubMed DOI:10.1038/nbt827
- Lewandrowski U., Moebius J., Walter U., Sickmann A. (2006). Elucidation of N-glycosylation sites on human platelet proteins: a glycoproteomic approach.. Mol. Cell. Proteomics 5: 226 — 233. PubMed DOI:10.1074/mcp.M500324-MCP200
Примітки
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:12028 (англ.). Процитовано 6 лютого 2017.
- UniProt, P14625 (англ.). Процитовано 6 лютого 2017.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.