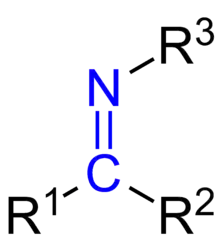
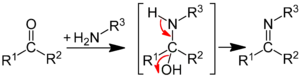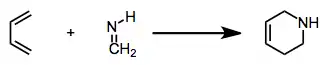Іміни
Імі́ни — органічні сполуки загальної формули R1R2C=NR3, де R1, R2 і R3 — H, Alk, Ar, є азотистими аналогами альдегідів (R2 = H, альдіміни) і кетонів (R1, R2 — Alk, Ar, кетіміни, що містять фрагмент NR3, з'єднаний подвійним зв'язком з атомом вуглецю). До іміну відносять також групу азометинів, тобто основи Шиффа.[1]
Номенклатура
У систематичній номенклатурі IUPAC суфікс -імін використовується для позначення фрагменту C=NH, виділеного кольором.
Фізичні властивості
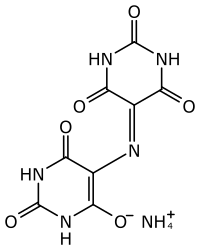
Іміни — маслоподібні або кристалічні речовини, зазвичай нерозчинні у воді і розчинні в органічних розчинниках. Неспряжені іміни безбарвні, при сполученні аміногрупи з ароматичною системою або системою подвійних зв'язків — забарвлені і можуть використовуватися як барвники (азометинові барвники) та індикатори, наприклад, мурексид:
Характеристична смуга іміногрупи в ІЧ-спектрах аліфатичних імінів лежить в області 1690–1640 см-1, у ароматичних (N-бензиліденанілінів) — в області 1631—–1613 см-1.
Отримання
Традиційним методом синтезу імінів є конденсація альдегідів і кетонів з первинними амінами. На першій стадії відбувається нуклеофільна атака аміногрупи по електрофільному карбонільному атому вуглецю з утворенням нестійкого гем-аміноспирта, який далі дегідратується до іміну:
У разі карбонільних сполук, які містять сильні електроноакцепторні замісники біля карбонільної групи (хлораль, гексафторацетон тощо), утворюються стабільні гем-аміноспирти.
Іміни також можуть бути синтезовані окисленням вторинних амінів надкислотами:
- R2CH-NHR1 + [O] → R2C=NR1 + H2O
або через утворення N-хлорамінів з подальшим відщепленням від них хлороводню:
- R2CH-NClR1 + OH– → R2C=NR1 + H2O + Cl–
Хімічні властивості
Атом азоту в молекулі іміну має слабо виражені нуклеофільні властивості, а атом вуглецю є сильним електрофілом. Тому імінам притаманні слабоосновними властивостями, а за відсутності води — здатність протонуватися і алкілюватися. При цьому реакція піде за рахунок атома азоту і призведе до утворення імінієвих солей:
- R2C=NR1 + R2Hal → R2C=N+R1R2·Hal–
Імінієві солі також можуть утворюються алкілюванням або ацилюванням імінів, продукти алкілювання можуть бути виділені, у разі ацилування проміжно утворюються ацилімінієві солі, що циклізуються в β-лактами (азетідін-2-они).
Реакції імінів з нуклеофілами протікають по атому вуглецю, дуже різноманітні і широко використовуються в органічному синтезі.
Так, іміни гідролізуються водою з утворенням карбонільних сполук і амінів, ця реакція зворотна до реакції синтезу імінів:
- R2C=NR1 + H2O → R2C=O + R1NH2
Реакції імінів з амінами призводять до утворення аміналей (гем-диамінів):
- R2C=NR1 + R1NH2 → R2C(NR1)2
Реакція імінів з ціаністим воднем або триметилсілілціанідом є варіантом реакції Штреккера і, в разі N-заміщених імінів, може слугувати методом синтезу N-заміщених α-амінокислот:
- R2C=NR1 + HCN → R2C(HR1)CN
- R2C(NHR1)CN + 2H2O → R2C(NHR1)COOH + NH3
Взаємодія реактиву Гріньяра або літійорганічних сполук з іміном призведе до C-алкілювання останніх з утворенням амінів:
- R2C=NR1 + R2Li → R2R2CN–R1·Li+
- R2R2CN–R1Li+ + H2O → R2R2CNHR1 + LiOH
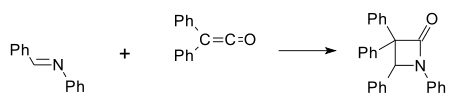
Іміни входять до різноманітних реакцій циклоприєднання, утворюючи з карбенів продукти (2+1)-циклоприєднання — азиридин, з кетенами йде (2+2) — циклоприєднання з утворенням азетідін-2-онів (синтез β- лактамів за Штаудінгером, формально — ацилювання імінів кетенами):
З 1,3-диполярними сполуками (діазометанами, нітрилоксидами) утворюються п'ятичленні гетероцикли — продукти (2+3) — циклоприєднання.
Іміни також можуть виступати в ролі діенофілів в реакції відомої як реакція Дільса — Альдера:
Під дією енергійних відновників (алюмогідрид літію, борогідрид натрію, водень над нікелем Ренея тощо) іміни відновлюються до вторинних амінів:
- R2C=NR1 + [H] → R2CH-NHR1
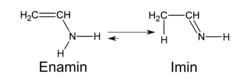
Іміни, утворені з енолізованих карбонільних сполук, здатні до імін-енамінної таутомерії:
Див. також
Література
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.