Бурштинова кислота
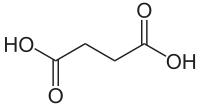
Буршти́нова кислота́, янта́рна кислота́, сукцина́т (бутандіова кислота, етан-1,2-дикарбонова кислота) НООССН2СН2СООН — органічна двохосновна насичена карбонова кислота.
| Бурштинова кислота | |
|---|---|
 | |
 | |
| Назва за IUPAC | бутандіова кислота |
| Інші назви | етан-1,2-дикарбонова кислота |
| Ідентифікатори | |
| Номер CAS | 110-15-6 |
| PubChem | 1110 |
| Номер EINECS | 203-740-4 |
| DrugBank | DB00139 |
| KEGG | C00042 |
| ChEBI | 15741 |
| SMILES |
C(CC(=O)O)C(=O)O |
| InChI |
1/C4H6O4/c5-3(6)1-2-4(7)8/h1-2H2,(H,5,6)(H,7,8) |
| Номер Бельштейна | 1754069 |
| Номер Гмеліна | 2785 |
| Властивості | |
| Молекулярна формула | C4H6O4 |
| Молярна маса | 118,09 г/моль |
| Густина | 1,56 г/см3 |
| Тпл | 184 |
| Ткип | 235 |
| Розчинність (вода) | 58 г/л (20 °C) |
| Кислотність (pKa) | pKa1 = 4,2 pKa2 = 5,6 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Загальні відомості
Вперше була отримана у XVII сторіччі з бурштину (лат. succinum — бурштин). Подробиці відкриття історією не збережено, не відомо навіть, хто був автором її відкриття.[1] В незначних кількостях міститься у бурому вугіллі та смолах. Виявлена в бурштині, багатьох рослинах (у недозрілих ягодах аґрусу, стеблах ревеню, винограді[2] і маку[2]), в бурому вугіллі тощо[3]. Із 32 різновидів бурштину, лише декілька видів містять вільну бурштинову кислоту.[1] В смолі сучасних хвойних дерев в більшості випадків зовсім не міститься бурштинової смоли, і лише в зовсім невеликій кількості видів міститься в концентрації 0,1 %, коли в бурштині її до 4,5 %.[1]
Кристали бурштинової кислоти після опромінення короткохвильовим ультрафіолетом здатні люмінесціювати, випромінюючи видиме світло.[1]
Є проміжним продуктом циклу трикарбонових кислот. Сукцинат є важливим проміжним продуктом обміну живих організмів, бере участь у процесах клітинного дихання (цикл трикарбонових кислот).
Властивості
Чиста кислота являє собою безбарвні кристали. Тверда речовина. Розчинна у воді та спирті, погано в ефірі, нерозчинна у бензолі, бензині, хлороформі. Метиленові групи бурштинової кислоти мають високу реакційну здатність завдяки впливу карбоксильних груп. Оскільки вона має два карбоксили — вона утворює два ряди солей (кислі і середні — зазвичай ці солі називають сукцинатами, від латинської назви бурштинової кислоти), два ряди складних ефірів, два ряди амідів і т. д.[1] Легко вступає у реакцію Фріделя—Крафтса з ароматичними сполуками, утворюючи похідні 4-арил-4-кетомасляної кислоти. При нагріванні, втрачає молекулу води, перетворюючись в циклічний ангідрид, який, будучи розчинений у воді, повільно перетворюється знову в кислоту.[1]
Отримання
У промисловості її отримують гідруванням малеїнового ангідриду або фумарової кислоти. Бурштинова кислота може бути отримана в результаті багатьох хімічних синтезів, із акрилової кислоти, акролеїна, етилену, ацетилену; шляхом окислення природної сировини (вугілля, сланці, торф, різні нафтові фракції) або таких органічних з'єднань, як оцтовий альдегід, фурфурол, бутиролактон; до цього результату може призвести відновлення малонової або фумарової кислоти.[1] Промисловий синтез бурштинової кислоти майже у всіх країнах заснований на реакціях відновлення.[1] В Радянському союзі синтетичну бурштинову кислоту вперше почали випускати з 1966 року на Єреванському заводі хімічних реактивів.[1]
Отримання з бурштину
Бурштинову кислоту можна отримати — шляхом сухої перегонки зплавлених і зпресованих обрізків та крихти бурштину (звісно, не придатних для виготовлення художніх виробів).[2][1] Для цього сировину ретельно подрібнюють і розплавляють в струмені вуглекислого газу. В бурштину немає чітко визначеної точки плавлення — він плавиться в інтервалі від 150 до 300 оС.[1] При подальшому нагріванні частину кислоти відганяють і вона осідає на охолоджених стінках реторти, а те, що залишилось, захоплюється так званою «бурштиновою олією» в приймач.[1] Повторною перегонкою цього дистиляту розділяють олію і кислоту. Обидві порції бурштинової кислоти об'єднують і перекристалізовують.[1]
Використання
Бурштинову кислоту та її похідні використовують для синтезу деяких барвників, інсектицидів, пластмас, ароматичних сполук, лікарських засобів[3]. Також використовують у сільському господарстві як добриво, вона прискорює дозрівання плодів, підвищує холодо- та посухостійкість, стійкість до захворювань, врожайність, збільшує вміст вітамінів та цукрів у плодах.
Примітки
- Кандидат химических наук Балуева Г. А. Кислота из янтаря / Научно-популярный журнал Академии Наук СССР «Химия и жизнь», 1983, № 11 ISSN 0130-5972 (с.: 58-61)
- Еромицкий А., Подгорный И. Янтарь — камень жизни / «Юный техник», 1965, № 03 (с.: 19)
- Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985.