Малеїновий ангідрид
Малеї́новий ангідри́д (рос. малеиновый ангидрид; англ. maleic anhydride, нім. Maleinanhydrid n) — органічна сполука ряду гетероциклів. При взаємодії з водою утворює малеїнову кислоту.
| Малеїновий ангідрид | |
|---|---|
 |
 |
| Ідентифікатори | |
| Номер CAS | 108-31-6 |
| Номер EINECS | 203-571-6 |
| Назва MeSH | D02.113.450 і D03.383.312.520 |
| ChEBI | 474859 |
| RTECS | ON3675000 |
| SMILES |
C1=CC(=O)OC1=O[1] |
| InChI |
InChI=1S/C4H2O3/c5-3-1-2-4(6)7-3/h1-2H |
| Номер Бельштейна | 106909 |
| Номер Гмеліна | 2728 |
| Властивості | |
| Молекулярна формула | C4H2O3 |
| Молярна маса | 98,057 г/моль |
| Зовнішній вигляд | біла речовина |
| Густина | 1,314 г/см³ (60 °C)[2] 1,480 г/см³ (20 °C) |
| Тпл | 52,96 °C[2] |
| Ткип | 202 °C[2] |
| Розчинність (вода) | 44,1% |
| Розчинність (ацетон) | 227 г/100 г |
| Розчинність (бензен) | 50 г/100 г |
| Розчинність (толуен) | 23,4 г/100 г |
| Розчинність (орто-ксилен) | 19,4 г/100 г |
| Розчинність (хлороформ) | 52,5 г/100 г |
| Розчинність (тетрахлорметан) | 0,6 г/100 г |
| Діелектрична проникність (ε) | 52,75 |
| В'язкість | 16,1·10-4 Па·с (60 °C) 10,7·10-4 (90 °C) 6·10-4 (150 °C) |
| Структура | |
| Кристалічна структура | орторомбічна |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-469,8 кДж/моль (твердий) -298,3 кДж/моль (газ) |
| Теплоємність, c |
0,119 Дж/(моль·K) (твердий) 0,164 Дж/(моль·K) (рідкий) |
| Небезпеки | |
| ГДК (Україна) | 6 мг/м³ |
| ЛД50 | 400 мг/кг (орально, пацюки) 465 мг/кг (орально, миші) 2620 мг/кг (шкіра, кролики) |
| Температура спалаху | 102 °C |
| Температура самозаймання | 477 °C |
| Вибухові границі | 1,4-7,1 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Випускається у вигляді порошку білого кольору і використовується як уповільнювач тужавіння та твердіння тампонажних розчинів за високих температур. Часто застосовується разом з сульфіт-дріжджевою бражкою (СДБ); постачається в поліетиленових мішках, вкладених у паперові мішки, чи в барабанах; зберігається за умов, які виключають зволоження.
Отримання
Отримання з бензену
Малеїновий ангідрид у промислових масштабах почали синтезувати починаючи із 1930-х років. Його отримували каталітичним окисненням бензену:
Для окиснювання великих об'ємів бензену застосовувався кисень повітря. Із підігрітим повітрям бензен утворює гомогенну газову суміш, яку утримують під тиском 0,15—0,25 МПа та пропускають над поверхнею каталізатору (V2O5, MoO3 у співвідношенні 70%:30%). Реакція є сильно екзотермічною: ентальпія взаємодії складає -1875 кДж/моль. Охолодження реактору здійснюється за рахунок циркуляції довкола нього евтектичних солей.
Окрім окиснення до ангідриду, значною є також побічна реакція окиснення бензену до CO та CO2: за оптимальних умов у ангідрид окиснюється близько 73% бензену, а 23% піддаються повному окисненню. Залишкові 4% можуть бути адсорбовані активованим вугіллям та повернені у реактор для повторної взаємодії.
Після виходу із реактору, суміш охолоджують до 150—160 °C, а згодом швидко охолоджують до 50—60 °C (тривале охолодження є небажаним через реакцію ангідриду із конденсованою водою). За цим методом може бути конденсовано із газової фази близько 40—60% ангідриду. Інша частина переходить у малеїнову кислоту і потім підлягає дегідратації. Дегідратацію проводять двома методами:
- змішуванням із «виштовхуючим агентом» — органічною сполукою (зазвичай, ксиленом), що утворює із водою азеотропні суміші і разом з нею відокремлюється від альдегіду;
- швидким випаровування тонкого шару розчину малеїнової кислоти при температурі 150—200 °C. При цьому може також утворюватися незначна частка (1—3%) ізомеру малеїнової кислоти — фумарової кислоти. Ангідрид відокремлюється у вигляді рідини.
Продукт після дегідратації додатково переганяють для досягнення чистоти у 99%.
Отримання з бутану
Cтрімке здорожчання бензену та, найголовніше, визнання його небезпечною сполукою змусило шукати іншу сировину для синтезу. І в 1974 році хімічним підприємством «Monsanto Company» був запропонований метод отримання малеїнового ангідриду із тетракарбонових вуглеводнів — н-бутану та його суміші з н-бутеном.
Реакція проходить на поверхні каталізатору ванадил пірофосфату (VO)2P2O6 (так званий VPO), який синтезують взаємодією V2O5 та H3PO4 у присутності відновників.
Концентрація бутану в реакційній системі обмежується 1,7% — за вищого вмісту він утворює вибухонебезпечні суміші.
Виділення ангідриду із суміші продуктів відбувається значно складніше, ніж у бензеновому методі: конденсувати вдається лише незначну частку ангідриду, а 65—70% гідратуються до малеїнової кислоти. Як варіант, для поглинання ангідриду застосовують органічні розчинники — таким чином відокремлюється до 98% речовини.
Хімічні властивості
У водному розчині малеїновий ангідрид легко утворює малеїнову кислоту (цис-бутендіову):
- (O)CCH2(O)CH2C(O) + H2O → HOOC-CH=CH-COOH
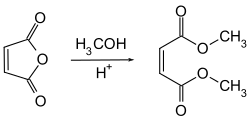
Реагує зі спиртами, за підвищених температур утворюючи подвійні естери:
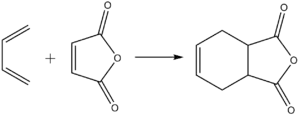
Подвійний зв'язок у гетероциклі є надзвичайно реакційноздатним: за ним проходять реакції гідрування, галогенування. За подвійним зв'язком відбувається приєднанням дієнів (реакція Дільса — Альдера):
Токсичність
Малеїновий ангідрид викликає подразнення очей, шкіри, слизових оболонок. Допустима концентрація у повітрі складає 0,25 мг/л. При тривалому вдиханні може провокувати набряк легень.
Для уникнення ушкоджень шкіри рекомендується використовувати гумові рукавички, а при наявності пилу ангідриду необхідно користуватися респіратором.
Застосування
Малеїновий ангідрид застосовується у реакціях поліконденсації полімерних сполук і синтезу кополімерів. Найважливішими кополімерами є малеїновий ангідрид—стирен і малеїновий ангідрид—акрилова кислота.
Невелика частина синтезованого малеїнового ангідриду застосовується у виготовленні ПАР, пестицидів та інгібіторів росту рослин (ретардантів).
Примітки
- MALEIC ANHYDRIDE
- За тиску 101,3 кПа
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Maleic Anhydride, Maleic Acid, and Fumaric Acid // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 15. — P. 447—461. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Lohbeck K., Haferkorn H., Fuhrmann W. Maleic and Fumaric Acids // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 2—7. — DOI: (англ.)
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)