Малонова кислота
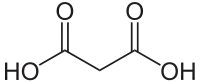
Мало́нова кислота́ (мета́ндикарбо́нова кислота, пропа́ндіо́ва кислота́), НООС-СН2-СООН — двоосновна гранична карбонова кислота. Як і всі дикарбонові кислоти, являє собою білу кристалічну речовину[1][2][3], розчинну у воді[4], з більш сильними кислотними властивостями, ніж одноосновні[2].
| Малонова кислота | |
|---|---|
 | |
| Назва за IUPAC | Пропандіова кислота |
| Систематична назва | Метилдикарбонова кислота |
| Ідентифікатори | |
| Номер CAS | 141-82-2 |
| Номер EINECS | 205-503-0 |
| DrugBank | 02175 |
| KEGG | C00383 |
| ChEBI | 30794 |
| RTECS | OO0175000 |
| SMILES |
C(C(=O)O)C(=O)O |
| InChI |
1S/C3H4O4/c4-2(5)1-3(6)7/h1H2,(H,4,5)(H,6,7) |
| Номер Бельштейна | 1751370 |
| Номер Гмеліна | 2550 |
| Властивості | |
| Молекулярна формула | C3H4O4 |
| Молярна маса | 104,061 г/моль |
| Молекулярна маса | 104,1 а. о. м. |
| Зовнішній вигляд | Безбарвна кристалічна речовина |
| Густина | 1.6г/см3 |
| Тпл | 135 °C |
| Ткип | Розкладається за температури, нижчої за температуру кипіння |
| Розчинність (вода) | 73,5 г/100г(20°C) |
| Розчинність (бензен) | 0,0014 |
| Кислотність (pKa) | 2,86 (pKa1), 5,7 (pKa2) |
| Дипольний момент | 2,57 D(20°C) |
| Термохімія | |
| Ст. ентальпія згоряння ΔcH |
864 кДж/моль |
| Небезпеки | |
| ГГС піктограми |   |
| ГГС формулювання небезпек | H302, H315, H318, H319, H335 |
| ГГС запобіжних заходів | P261, P264, P270, P271, P280, P301+312, P302+352, P304+340
,P305+351+338, P310, P312, P321, P330, P332+313, P337+313, P362 ,P403+233, P405, P501 |
| Пов'язані речовини | |
| Інші (двоосновні карбонові кислоти) | Щавелева кислота, Бурштинова кислота |
| Пов'язані речовини | Діоксид тривуглецю |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Солі та складні ефіри малонової кислоти називаються малонатами. Сік цукрового буряка, наприклад, містить малонат кальцію[5].
Вперше відкрита у 1858 році.[6]
Хімічні властивості
При взаємодії з оксидом фосфору дегідратується з утворенням діоксиду тривуглецю[2]:
Реакції за участі карбоксильної групи
Має всі хімічні властивості, характерні для карбонових кислот. У водних розчинах розпадається на малонат-іон та протон:
pKa = 2,86[4]
pKa = 5,7[4]
При нагріванні до 133-135°С декарбоксилюється з утворенням оцтової кислоти та вуглекислого газу[2]:
Взаємодіє з тіонілхлоридом з утворенням повного чи неповного хлорангідриду малонової кислоти[5]:
(повний хлорангідрид)
(неповний хлорангідруд)
При взаємодії з аміаком утворює аміди:
Реакції за участі метиленової групи
Внаслідок електроноакцепторної дії двох карбоксильних груп атоми гідрогену в метиленовій групі проявляють кислотні властивості. Тому вприсутності основ малонова кислота може утворювати не дільки діаніон, а й трианіон[2]:
Основи приєднуються до цієї кислоти, стаючи донорами електронної пари для протона. Такі солі (якщо там трианіон) можуть приєднувати альдегіди та кетони.Продукти цієї реакції під дією кислот утворюють ненасичені двоосновні карбонові кислоти, які при нагріванні декарбоксилюються, утворюючи одноосновні ненасичені карбонові кислоти:[2][6]
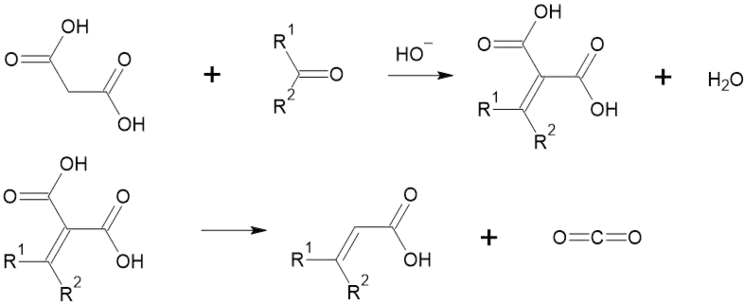
У присутності червоного фосфору взаємодіє з бромом. У цій реакції утворюється 2-броммалонова кислота чи диброммалонова кислота:[5]
Отримання
Основним способом одержання малонової кислоти є реакція ціаніду калію з хлорацетатом натрію. При кислотному гідролізі отриманого нітрилацетату натрію утворюється малонова кислота[2]:
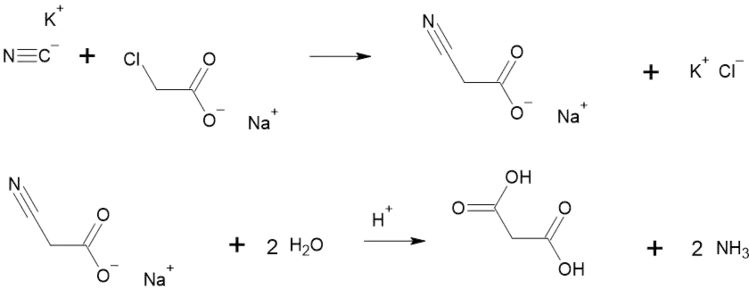
Інші способи:
Див. також
Примітки
- ICSC 1085 - МАЛОНОВАЯ КИСЛОТА. ilo.org.
- Нейланд (1990). Органическая химия. с. 557–559. ISBN 5-06-001471-1.
- Malonic acid|C3H4O4 - PubChem. pubchem.ncbi.nlm.nih.gov.
- Пропандиовая кислота - физико-химические свойства|CHEMDB.NET.
- XuMuK.ru - МАЛОНОВАЯ КИСЛОТА - Химическая энциклопедия. xumuk.ru (російська).
- Considine, Glenn D., ред. (15 липня 2005). Malonic Acid and Derivatives. Van Nostrand's Encyclopedia of Chemistry (англ.). Hoboken, NJ, USA: John Wiley & Sons, Inc. с. vec1571. ISBN 978-0-471-74003-2. doi:10.1002/0471740039.vec1571.
