Докозагексаєнова кислота
Докозагексаєнова кислота (ДГК) — поліненасичена жирна кислота (ПНЖК) класу Омега-3. Є складовою ліпідів більшості тканин тварин. Велика кількість ДГК міститься у риб’ячому жирі лосося та атлантичного оселедця, зоопланктоні, морських молюсках, динофітових мікроводоростях. Докозагексаєнова кислота, нарівні з ейкозапентаєновою кислотою (ЕПК), належить до найцінніших для здоров’я людини ПНЖК Омега-3.
| Докозагексаєнова кислота | |
|---|---|
 | |
 |
 |
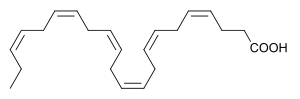
| Назва за IUPAC | (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнова кислота |
| Ідентифікатори | |
| Номер CAS | 6217-54-5 |
| PubChem | 445580 |
| Номер EINECS | 612-950-9 |
| DrugBank | 03756 |
| Назва MeSH | D10.212.302.380.410.210, D10.251.355.337.250 і D10.627.430.450.375 |
| ChEBI | 28125 |
| SMILES |
O=C(O)CC\C=C/C/C=C\C\C=C/C\C=C/C\C=C/C\C=C/CC |
| InChI |
1/C22H32O2/c1-2-3-4-5-6-7-8-9-10-11-12-13-14-15-16-17-18-19-20-21-22(23)24/h3-4,6-7,9-10,12-13,15-16,18-19H,2,5,8,11,14,17,20-21H2,1H3,(H,23,24)/b4-3-,7-6-,10-9-,13-12-,16-15-,19-18- |
| Номер Бельштейна | 1715505 |
| Властивості | |
| Молекулярна формула | C22H32O2 |
| Молекулярна маса | 328,488 г/моль |
| Зовнішній вигляд | рідина |
| Густина | 0,943 г/см3 |
| Тпл | -44 °C |
| Ткип | 446,7 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
З 1975 року увага вчених прикута до перспективного класу препаратів – ω-3 поліненасичених жирних кислот, відколи Йорн Дьєрберг (Jørn Dyerberg) і Банг Хо (Bang HO) пов’язали низький рівень ССЗ ескімосів Гренландії із підвищеним вживанням цих кислот. Їхніми природними джерелами є риб’ячий жир глибоководних риб Північної півкулі та деякі рослинні олії. Вживання цих кислот корелює зі зниженням частоти розвитку ішемічної хвороби серця, інфаркту міокарду, атеросклерозу та зменшенням випадків смертності від цих захворювань.
Фармакологічні дослідження
Це підтверджено масштабним подвійним, сліпим, плацебо-контрольованим дослідженням GISSI-Prevenzione, проведеним у 1999 році італійськими вченими для вивчення виживання хворих після інфаркту міокарда. За результатами дослідження, ω-3 ПНЖК включені до списку препаратів вторинної профілактики у хворих, що перенесли інфаркт міокарда. Важливими виявились також їх гіполіпідемічні, антиагрегантні, антиаритмічні, гіпотензивні, протизапальні ефекти. Завдяки цим ефектам, вчений U. N. Das в своїх роботах пропонує послуговуватися ω-3 ПНЖК замість аспірину. Наразі фармацевтична промисловіть випускає наступні препарати ω-3: «Вітрум кардіо Омега-3», «Омакор», «Епадол», «Ейконол», «Omega 3»(ЕПК). Серед механізмів впливу ω-3 ПНЖК на перше місце претендує зміна жирнокислотного фосфоліпідного складу клітинних мембран кардіоміоцитів. В результаті зазначеної модифікації відновлюється фізіологічне співвідношення ω-3:ω-6 ПНЖК внаслідок зниження кількості останніх. Похідними ω-6 ПНЖК є тромбоксан А2, лейкотрієн В4, С4, що викликають агрегацію тромбоцитів, вазоконстрикцію, запальні явища. Метаболітами ω-3 ПНЖК є простагландин D3, Е3, F3, І3, тромбоксан А3, лейкотрієн А3, В3, С3, D3, які спричиняють вазодилатацію, є антиагрегантами, протизапальними речовинами.
Також в літературі описано вплив ω-3 ПНЖК на йонні Na+, K+, Ca2+ канали, Na+/Н+ обмінник. Наслідком зазначених впливів є зменшення вірогідності виникнення аритмій та загального навантаження на серце, стабілізація мембран кардіоміоцитів.
Дослідження останніх років присвячені впливу ω-3 ПНЖК на адренорецептори та мускаринові ацетилхолінові рецептори. За їх результатами доведено, що ПНЖК зменшують адренореактивність у відповідь на ізопротеренол, зменшують хронотропні, інотропні відповіді на норадреналін та збільшують експресію холінергічних рецепторів.
При гіпертрофії міокарда знижується вміст лінолевої кислоти у фосфатидилхоліну, фосфатидилетаноламіну та кардіолопінових фракціях, підвищується вміст ДГК, арахідонової кислоти у фосфатидилхоліні, ДГК – у фосфатидилетаноламіні, також підвищується вміст олеїнової кислоти у кардіоліпіновій фракції. Згідно з нещодавніми дослідженнями показано, що ω-3 ПНЖК мають антиатерогенний, антитромботичний, антиаритмічний, антигіпертензивний, протизапальний ефекти. Вони рекомендовані як складова вторинної профілактики ІХС у складі препаратів епадол, ейконол, омакор, вітрум-кардіо ω-3, NSP ω-3 (ЕПК). Одним з важливих механізмів кардіопротекції слід вважати зменшення адренергічних впливів на серце при патологічних станах. За даними Меєрсона, Манешиной ω-3 ПНЖК зменшують реактивність судин через вплив на βАР. У 1995 Алайн Грінберг (Alain Grynberg) показав[1], що вони зменшують щільність, афінність (спорідненість) βАР до ліганду, зменшують адренореактивність у відповідь на ізопротеренол, зменшують хронотропні, інотропні відповіді на НА. Автори пояснюють цей позитивний ефект через вплив на систему вторинних месенджерів. S Teres у 2008 році показано, що ω-3 ПНЖК зменшують концентрацію G-білку, інозитол-1,4,5-біфосфату, діацилгліцеролу, внутрішньоклітинного цАМФ, аденілатциклази. Відомо, що зниження активності аденілатциклази та циклічного аденозинмонофосфату (цАМФ) – критерій гіпертензії у людей. Співробітниками відділу загальної і молекулярної патофізіології Інституту фізіологіїї НАН України при дослідженні адренергічних реакцій на ізольованих кільцях аорти показано послаблення реактивності судин на дію вазоконстриктора (норадреналіна), ангіотензину II в групі тварин, які отримували ω-3, в порівнянні з контрольною групою, де реакція судин була більшою.
Нещодавні дослідження показали, що ω-3 ПНЖК підвищують щільність М1-холінергічних рецепторів в тканині гіпокампу щурів. Дослідники пов'язують це з фактом, що ω-3 підвищують текучість мембрани, а при цьому підвищується афінність серотонінових, М-холінергічних, дофамінових рецепторів. У 2006 р E Machova et al. виявили, що ДГК у концентрації 100 mM збільшує кількість поверхневих М-холінорецепторів, активність ацетилхолінестерази і, опосередковано, експресію холінергічних рецепторів, у дослідах на гіпокампі щурів. Механізм автори пов'язують з попередженням апоптозу (за їх даними різко падає активність каспази-3).
Ще у 1992 році вивчали вплив ω-3 ПНЖК на іонні канали. Дослідники McLennan et al. показали блокування Na+ каналів як прояв антиаритмічного впливу ω-3 в експериментах на тваринах і культурах клітин. У 1993 році Taffet et al. виявили пригніченя Са2+-АТФаз, що пов'язано з меншим навантаженням кальцієм СПР. Negretti et al., звернули увагу на пригнічення Na+-Ca2+ насосу із зменшенням залишкової концентрації Са2+. Це пов'язано з меншим спонтанними вивільненням Са2+ із СПР через зменшенням входу Са2+ через Са2+ канали. E. M. Pound et al у 2001 році виявили блокування INa, ICa,L ПНЖК і попередження злоякісних аритмій, пригніченя ITo (реполяризуючого К+ струму ), ІК ( початкових швидких зовнішніх реполяризуючих струмів), І Cl, І KaChol (ліганд-активованого ацетилхолінового калієвого каналу). Ще у 1998 році Когтев, Безуглова доповіли, що довголанцюгові ЖК активують КАТФ канали гладком'язових клітин. За свідченням A Leaf et al.,(1999) ПНЖК стабілізують електричну активність кардіоміоцитів таким чином: отримується сильніший електричний стимул для створення потенціалу дії і рефрактерний період помітно подовжується. Антиаритмічний ефект ПНЖК проявляється у пригніченні Na+ каналу (ініціює потенціал дії і скоротливість тканин) і L–типу Са2+ каналу (ініціює вивільнення запасів Са2+ з СПР з наступним підвищенням концентрації вільного цитоплазматичного Са2+ і активує скоротливі білки міоцитів). Зазначені дані корелюють з результатами M Hirafuji et al., про те, що інгібування L-типу Са2+ каналів і активація КАТФ-каналів призводить до зниження концентрації внутрішньоклітинного Са2+ і покращення судинореактивності. Goel et al у 2002 році доповіли про активацію Na+/H+ обміну при ішемії-реперфузії, що викликало аритмію, пошкодження клітин з подальшою клітинною смертю. ω-3 ПНЖК пригнічують сарколемальний Na+/H+ обмін і вхід Na+ в ізольовану саркоплазму кардіоміоцитів. За даними Kamata et al., 2006 при стрептозотоцин-індукованому діабеті щурів збільшується кількість похідних арахідоновї кислоти. В той же час є дані про те, що ω-3 ПНЖК зменшують ці метаболіти. Також за участю активації PPARα , ω-3 ПНЖК знижують тригліцериди плазми крові. Відомо також про зниження ліпопротеїдів дуже низької щільності, що є сприятливим для перебігу ЦД. За даними Crespo et al. 2008, ПНЖК покращують функцію ендотелію ( збільшують активність eNOS, EDHF ). M Nishimura et al дослідили покращення засвоювання інсуліну β-клітинами (через збільшення чутливості до інсуліну), сприяння меншому накопиченню жирової тканини і зниження рівня глюкози (через зниження активності транспортера глюкози GLUT-4) у щурів при дії ЕПК. Dincer et al покзали зменшення активності симпатичної нервової системи (через зменшення концентрації норадреналіну в шлуночках, лівому передсерді; зменшення експресії β1АР). В дослідах на мишах з цукровим діабетом показано, що застосування ω-3 ПНЖК дає максимальне розслаблення кілець аорти (які попередньо скорочені НА) у порівнянні з дієтою з моненасиченими жирами ( поодинокі дослідження ). За даними Suresh et al., 2003 ω-3 ПНЖК попереджують розвиток ЦД 1 типу у цуценят від матерів, що приймали ω-3 ( попереджують аллоксан-індуковану токсичність β-клітин – стабілізують активність СОД, каталази, глутатіон-пероксидази, NO ).
Примітки
- Grynberg, Alain; Aline Fournierb, Jean Pierre Sergiela, Pierre Athiasb (November 1995). Вплив докозагексаєнової та ейкозапентаєнової кислот у фосфоліпідах на адренорецептори клітин серцевого м'яза щурів, чутливість і механізм (Effect of Docosahexaenoic Acid and Eicosapentaenoic Acid in the Phospholipids of Rat Heart Muscle Cells on Adrenoceptor Responsiveness and Mechanism). Journal of Molecular and Cellular Cardiology (Elsevier Ltd.) 27 (11): 2507–2520.
