Електрофільне ароматичне заміщення
Електрофільне ароматичне заміщення (англ. Electrophilic aromatic substitution) — тип реакції електрофільного заміщення на ароматичному кільці. Він є найпоширенішим і найбільш важливим серед реакцій заміщення ароматичних сполук.
Механізм реакції
Для ароматичних систем фактично існує один механізм електрофільного заміщення — SEAr. Механізм SE1 (за аналогією з механізмом SN1) — зустрічається вкрай рідко, а SE2 (відповідний за аналогією SN2) — не зустрічається зовсім[1].
Механізм реакції SEAr складається з двох стадій. На першому етапі відбувається приєднання електрофіла, на другому — відщеплення електрофуга:

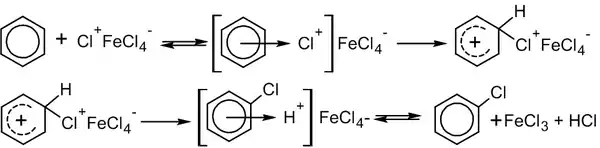
В ході реакції утворюється проміжний додатно заряджений інтермедіат (на малюнку — 2b). Його називають інтермедіат Веланда, аренієвий іон, ареній-катіон або σ-комплекс. Цей комплекс, як правило, дуже реакцієздатний і легко стабілізується, швидко відщеплюючи катіон.
Лімітувальною стадією в переважній більшості реакцій SEAr є перший етап.
Швидкість реакції SEAr зазвичай подається в такому вигляді[2]:
| Швидкість реакції = k*[ArX]*[E+] |
Атакувальною частинкою зазвичай виступають відносно слабкі електрофіли, тому в більшості випадків реакція SEAr протікає під дією каталізатора — кислоти Льюїса. Частіше за інших використовуються AlCl3, FeCl3, FeBr3, ZnCl2.
У цьому випадку механізм реакції виглядає так (на прикладі хлорування бензолу, каталізатор FeCl3)[3]:
1. На першому етапі каталізатор взаємодіє з атакувальною частинкою з утворенням активного електрофільного агента:
2. На другому етапі, власне, й реалізується механізм SEAr:
Пряме електрофільне амінування
Реакція прямого електрофільного амінування ароматичних вуглеводнів з отриманням ароматичних амінів довгий час вважалася неможливою. Над пошуком умов такої реакції і її здійсненням працювали низка хіміків протягом багатьох років, зокрема лауреат Нобелівської премії з хімії Джордж Ола, проте безуспішно. 2019 року російські вчені з Томського політехнічного університету під керівництвом керівника Науково-освітнього центру ім. Н. М. Кіжнера професора В. Д. Філімонова вперше в світі здійснили реакцію прямого електрофільного амінування ароматичного ядра[4]. Томські дослідники довели, що пряме амінування аренів гідразойною кислотою йде за класичним механізмом SEAr, причому електрофілом є катіон амінодіазонію H2N3+[5]. Особливість електронної структури H2N3+ була описана з використанням нового методу трасування молекулярних орбіталей. За допомогою методів квантової хімії дослідники описали всі стадії реакції прямого амінування і знайшли інтермедіат — проміжну сполуку, через яку йде реакція. Нею виявилася сіль амінодіазонію. Швидкість реакції прямого амінування визначається раннім перехідним станом між π- і σ-комплексами. Російські хіміки показали, що за своїм механізмом реакція прямого амінування аренів HN3 близька до реакцій нітрування і галогенування, займаючи проміжне положення між ними. Дослідники сподіваються, що відкрита ними нова хімічна реакція не тільки значно полегшить отримання вихідної сировини для багатьох лікарських препаратів і іншої корисної продукції[6], але й підкаже хімікам шляхи здійснення багаторічної мрії — прямого синтезу аніліну з бензолу[7]. Результати дослідження опубліковано в журналі Chemistry Select.
Типові реакції ароматичного електрофільного заміщення
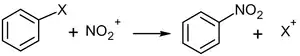
1. Нітрування ароматичних систем азотною кислотою в присутності сульфатної кислоти з отриманням нітросполук:

Утворення активної частинки[2]:
| Швидкість реакції = k*[ArH]*[NO2+] |
2. Сульфування бензолу з отриманням сульфокислоти:

Активною частинкою в реакції є SO3.
3. Галогенування бензолу бромом, хлором або йодом призводить до утворення арілгалогенідів. Каталізатором реакції виступає галогенід заліза(III):
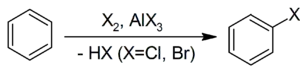
Утворення активної частинки[2]:
| Швидкість реакції = k*[ArH]*[X2]*[FeX3] |
4. Реакція Фріделя-Крафтса — ацилювання або алкілювання з використанням ацил- або алкілгалогенідів. Типовим каталізатором реакції служить хлорид алюмінію, але може використовуватися будь-яка інша сильна кислота Льюїса.
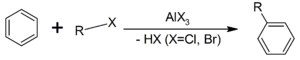
| Швидкість реакції = k*[ArH]*[RX]*[AlCl3] |
Реакційна здатність і орієнтація в похідних бензолу
Замісники в бензольному кільці можуть як сприяти реакції заміщення (активувальні замісники), так і сповільнювати швидкість реакції (дезактивувальні замісники). Деякі групи орієнтують заміщення в орто- і пара- положення, інші — в мета.
Вплив різних груп на реакційну здатність пояснюється стійкістю, інакше кажучи, енергією активації, що вимагається для отримання трьох можливих проміжних інтермедіатів[1].
Реакційна здатність і орієнтація різних груп у похідних бензолу[1][8]:
| Положення | Сильноактивувальні замісники | Активувальні замісники | Дезактивувальні замісники | Сильно дезактивувальні замісники |
|---|---|---|---|---|
| орто- і пара- заміщення | OH, NH2, NHR, NRR' | Ar, R, OR, NHCOR, OCOR, SR | Cl, Br, I | немає |
| мета- заміщення | немає | немає | CHO, COR, COOH, COOR, CCl3 | NO2, CN, NH3+ |
У заміщених бензолах можлива так звана іпсо- атака, тобто заміщення наявного замісника іншим:
Примітки
- Mарч Дж. Органическая химия, пер. с англ., т. 2, — M.: Мир, 1988
- Сайкс П. Механизмы реакций в органической химии, 4-е изд. / Пер. с англ.,под редакцией В. Ф. Травеня — M.: Химия, 1991 — ISBN 5-7245-0191-0
- Травень В. Ф. Органическая химия, М.: ИКЦ «Академкнига», 2004. — ISBN 5-94628-068-6.
- Российские химики нашли способ быстрого получения ароматических аминов. indicator.ru. Процитовано 25 травня 2019.
- Ksenia S. Stankevich, Alexander A. Bondarev, Anastasia K. Lavrinenko, Victor D. Filimonov. // ChemistrySelect. — 2019. — Iss. 10. — P. 2933–2940. — ISSN 2365-6549.
- Ученые назвали механизм быстрого получения сырья для лекарств. Planet Today. 20 Мая 2019 18:51.
- Ученые определили механизм быстрого получения сырья для лекарств и красителей. ТАСС. Процитовано 25 травня 2019.
- Керри Ф, Сандберг Р. Углубленный курс органической химии: пер. с англ., в 2-х томах. — М.: Химия, 1981.