Карбід кальцію
Карбі́д ка́льцію — хімічна сполука, кальцієва сіль ацетилену (CaC2), яка використовується при проведенні автогенних робіт.
| Calcium carbide | |
|---|---|
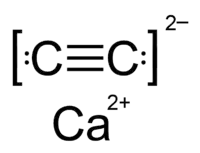 Calcium Carbide | |
 | |
| Назва за IUPAC | Calcium Carbide |
| Ідентифікатори | |
| Номер CAS | 75-20-7 |
| PubChem | 6352 |
| Номер EINECS | 200-848-3 |
| RTECS | EV9400000 |
| SMILES |
[Ca+2].[C-]#[C-] |
| InChI |
1/C2.Ca/c1-2;/q-2;+2 |
| Властивості | |
| Молекулярна формула | CaC2 |
| Молярна маса | 64.099 g/mol |
| Зовнішній вигляд | Білий порошок (часто сірий через домішки) |
| Густина | 2.22 г/cм3 |
| Тпл | 2160 |
| Розчинність (вода) | decomposes |
| Структура | |
| Кристалічна структура | Tetragonal [1] |
| D174h, I4/mmm, tI6 | |
| Координаційна геометрія |
6 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
−63 kJ·mol−1 |
| Ст. ентропія S |
70 J·mol−1·K−1 |
| Небезпеки | |
| NFPA 704 |
 3
3
2
|
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |

Фізичні властивості
Карбід кальцію — тверда кристалічна безбарвна речовина. Технічний продукт має колір від світло-бурого до чорного, дає кристалічний злам сірого кольору з різними відтінками залежно від чистоти.
Отримання
Карбід кальцію отримують відновленням оксиду кальцію вугіллям при температурах 2000—2300 °C:
Технічний продукт («карбід») містить тільки 80-85 % власне карбіду кальцію, решту становить непрореагований оксид кальцію, а також сульфід, нітрид та фосфід кальцію, які утворюються через присутність домішок фосфату та сульфату кальцію у вихідному оксиді.
Застосування
Карбід кальцію застосовують для виробництва ацетилену і у виробництві ціанаміду кальцію, з якого у свою чергу отримують добрива та ціаністі сполуки. Ацетилен, одержаний із карбіду кальцію, використовують при проведенні автогенних робіт і для освітлення, а також у виробництві ацетиленової сажі і продуктів органічного синтезу, з яких головним є синтетичний каучук. Крім того, виходячи з карбіду кальцію, отримують вінілхлорид, акрилонітрил, оцтову кислоту, етилен, штучні смоли, ацетон, стирол тощо.
Упаковка і зберігання карбіду кальцію
Карбід кальцію упаковують в сталеві барабани всіх типів герметичного виконання місткістю 100 дм3, вагою 100 кг, що герметично закриваються.
Карбід кальцію зберігають на відкритих майданчиках під навісом або в складах, що не згорають, добре провітрюваних, виключають попадання вологи, у вертикальному положенні, не більше ніж в три яруси. Гарантійний термін зберігання продукту — 6 місяців з дня виготовлення.
Берегти від вологи і вогню!
Хімічні властивості
З водою карбід кальцію бурхливо реагує з виділенням ацетилену та утворенням гідроксиду кальцію, реакція проходить з сильним виділенням тепла. Уже атмосферної вологи достатньо, аби цей процес повільно відбувався.
Також карбід кальцію при високих температурах здатен реагувати з азотом з утворенням ціанаміду кальцію:
Вище 2200°C відновлюється воднем:
Сильний відновник, відновлює більшість оксидів металів до карбідів чи вільних металів. Окиснюється на повітрі при нагріванні вище 700°C.
Небезпека для людини
Карбід кальцію за впливом на організм відноситься до речовин 4-го класу небезпеки. Головним джерелом небезпеки для людини при роботі з карбідом кальцію є продукти його реакції з водою. Пил карбіду кальцію сильно подразнює шкіру, органи дихання та очі (оскільки активно реагує з вологою).
Технічний карбід кальцію містить домішки фосфіду кальцію, з якого при взаємодії з водою виділяється отруйний із різким запахом фосфін (PH3). Основний продукт, ацетилен, утворює вибухонебезпечні суміші з повітрям.
Індивідуальні засоби захисту
При роботі з промисловими кількостями — протипилові респіратори і протигаз з коробкою марки типу БКФ, що фільтрує.
Необхідні дії в аварійних ситуаціях
При пожежі як засоби пожежогасіння слід використовувати сухі порошкові вогнегасники, вуглекислоту, сухий пісок, азбестове полотно. Гасити водою не дозволяється.
При попаданні карбіду кальцію на шкіру і в очі — негайно промити великою кількістю води, шкіру змастити вазеліновим маслом.
Джерела
- Карбиды // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Сов. энцикл., 1990. — Т. 2 : Даффа реакция — Меди сульфат. — Стб. 623. — Библиогр. в конце ст. — ISBN 5-85270-035-5.(рос.)
Примітки
- Massalimov, I. A.; Kireeva, M. S.; Sangalov, Yu. A. (2002). Inorganic Materials 38 (4): 363. doi:10.1023/A:1015105922260.