Міозин
Міози́ни — це суперродина моторних білків еукаріот, що взаємодіють із мікрофіламентами, забезпечуючи різні форми руху клітини. Найбільш відомий міозин II, поширений у м'язовій тканині, де він разом із актином утворює актоміозин — основну складову частину скоротливих ниток м'язових волокон.
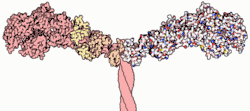
Міозин II складається із шести поліпептидних ланцюгів: двох однакових важких (довжиною приблизно 2000 амінокислотних залишків) і чотирьох легких двох різних типів. Важкі ланцюги на N-кінці містять глобулярні моторні домени або «голівки», які безпосередньо задіяні у генерації сили. До цих доменів приєднуються легкі ланцюги. Інша частина важких ланцюгів представлена довгими витягнутими спіралями, що беруть участь у димеризації, утворюючи біспіраль (англ. colied coil). Завдяки взаємодії таких хвостів кількох сотень молекул міозину утворюються «товсті філаменти». Вони є біполярними, тобто голівки на двох кінцях філаменту напрямлені у різні сторони. Молекули міозину розташовані в товстому філаменті таким чином, що голівки регулярно розподіляються по всій її довжині, крім невеличкої ділянки посередині, де їх немає («гола» зона). У тих місцях, де нитки актину і міозину перекриваються, міозинові голівки можуть прикріплюватися до сусідніх актинових ниток, і в результаті цієї взаємодії відбувається скорочення м'яза. Енергія для виконання такої роботи вивільняється при гідролізі АТФ; усі міозинові голівки мають АТФазну активність, прикріплення міозинових голівок залежить від концентрації іонів Са2+ у саркоплазмі. Міозинова АТФаза активується при взаємодії актину з міозином. Іони Mg2+ можуть інгібувати цей процес.
Спершу вважалось, що міозин наявний лише у м'язах, проте у 1970-их було виявлено, що схожі молекули зустрічаються в інших типах клітин, в тому числі і в одноклітинних організмів. Приблизно в той же час у прісноводної амеби Acanthamoeba castelanii був знайдений білок, що мав моторний домен дуже схожий до такого у міозину м'язів, який проте працював як мономер і мав зовсім інший хвостовий домен. Цей тип міозину назвали міозином I (одноголовий), а міозин м'язів перейменували у міозин II (двоголовий). З того часу ця суперродина білків завдяки аналізу геномів багатьох еукаріот поповнилась новими членами і налічує більше 37 окремих родин. Всі міозини об'єднані схожими N-кінцевими глобулярними головами, частина із них «одноголові», інші — двоголові, тому номенклатура стала відображати не кількість голів, а час відкриття. Відмінності між родинами міознинів криються переважно у хвостових ділянках, що еволюціонували для взаємодії із різними типами вантажів. Всі міозини окрім шостого рухаються до плюс кінця актинових філаментів.
Більшість із міозинів наявні в усіх еукаріот, і поширення тільки невеликої частини обмежене вужчими групами, наприклад, міозини XVIII і XI — зустрічаються лише у рослин, а IX — у хребетних тварин. У геномі людини наявні 40 генів міозинів, дев'ять із яких експресуються головним чином (або тільки) у волоскових клітинах внутрішнього вуха, де вони беруть участь в організації стереоцілій. Мутації у генах принаймні трьох із цих міозинів можуть призвести до глухоти.
Суперсімейство міозинів в організмі людини
Міозини представляють собою молекулярні мотори, які переміщуються вздовж актинових волокон завдяки енергії гідролізу аденозинтрифосфату (АТФ). Кожен представник цієї родини має аналогічну будову, зокрема N-кінцевий домен (виконує функцію двигуна), «важіль», і C-кінець. «Двигун» з'єднується з актином і здійснює гідроліз АТФ. В свою чергу, «важіль» являє собою α-спіраль, яка простягається від двигуна, і містить від одного до шести амінокислот його альфа-спіральну конформацію. Варто зазначити, що ця взаємодія не вимагає Ca2+.
Проте, важіль міозину-6 містить додатковий кальмодулин-зв'язуючий домен (KVQWCSLSVIKLKNKIKYR), який розташований на N-кінц, і який вимагає наявності іонів кальцію у цитозолі.
У геномі людини існує близько 39 різних генів міозинів, які організовані в 12 різних класів. Ці класи утворені на основі подібності нуклеотидних послідовностей різних генів міозину.
Більшість клітин експресують щонайменше 20 різних типів міозину, які включають представників принаймні, шести різних класів надсемейства міозинів, в тому числі декілька ізоформ міозину 1, нем'язові ізоформи міозину 2 (нм2) і міозинів 5, 6, 9 і 10.
Міозинам приписують багато функцій, зокрема міграція клітин, адгезія і внутрішньоклітинна моторика.
Характеристики окремих представників міозинів наведені у таблиці[джерело?]:
| Ізоформа міозину | Молекулярна маса (кДа) | Функція в клітині | |
|---|---|---|---|
| Міозин 1А | 118 | Важливе значення відіграє для мембранного цитоскелета при адгезії. Є головним в мікроворсинках епітеліальних клітин. | |
| Міозин 1B | 132 | Ендоцитоз і рухи мембрани | |
| Міозин 1C | 121 | Димери цього білку полімеризують актин до ендоцитарних везикул (в організмі жаби), також приєднують актин до цитоскелету мембрани.
При зміненій формі двигуна асоційований із глухотою. Деякі варіанти були знайдені у ядрі у вигляді комплексів із РНК-полімеразою II. |
|
| Міозин 1D | 116 | Функція не з'ясована. | |
| Міозин 1E | 127 | Сприяє компактизації актинових облонок на екзоцитарних/ендоцитарних везикулах. | |
| Міозин 1F | 125 | Переважає в імунних клітинах, модулює адгезію за допомогою корового актину.
Порушення пов'язані із глухотою. |
|
| Міозин 1G | 116 | Локалізований переважно у лейкоцитах. | |
| Міозин 1H | 119 | Зафіксований у внутрішньому вусі. | |
| Нем'язовий міозин 1А | 226 | Регулює клітинну адгезію. Велику роль відіграє у нирках, тромбоцитах, оптичній системі ока та внутрішньому вусі.
Утворює пари у систему мікротрубочок. |
|
| Нем'язовий міозин 2В | 229 | Забезпечує полярнсть клітин під час їх міграції, клітинну адгезію. | |
| Нем'язовий міозин 2С | 228 | Роль до кінця не встановлена. Існують припущення, що цей білок бере участь у клітинній адгезії. | |
| Міозин 3 | 224 | Є специфічним для фоторецепторів | |
| Міозин 5a | 215 | Бере участь у процесах ендо- та екзоцитозу, везикулярному транспорті. | |
| Міозин 5b | 214 | Задіяний у відновленні рецептору трансферину .
Є необхідним для мікроворсинок тонкої кишки. Здатен вхаємодіяти із РНК-полімеразою І. Сприяє обміну GLUT4 в скелетних м'язах. |
|
| Міозин 5c | 202 | Відновлення рецептору трансферину. | |
| Міозин 6 | 150 | Бере участь у регулюванні транспорту в апарат Гольджі, ендоцитозі, сортування мікропухирців. | |
| Міозин 7a | 254 | Є небхідним для формування склероцій ворсинок внутрішнього вуха.
Задіяний у транспорті пігментів до рогівки. |
|
| Міозин 7b | 242 | Задіяний у мембранному транспорті. Знайдений у мікроворсинках кишечника та нирках. | |
| Міозин 9a | 293 | Є вадливим для утворення зв'язків між епідермальними клітинами (зокрема в селезінці). | |
| Міозин 9b | 244 | Взаємодіє із актином та забезпечує полярність клітин під час їх зв'язку із Rho. | |
| Міозин 10 | 237 | Бере участь у формуванні філоподій та адгезії їхніх накопечників. | |
| Міозин 15a | 395 | Високий рівень експресії зафіксований у гіпофізі. Також знайдений у нирках, печінці, підшлунковій залозі, легенях, плаценті та скелетних м'язах. | |
| Міозин 16 | 211 | Висока експресія цього білку зафіксована в мозку (астроцити, церебральні нейрони). | |
| Міозин 18a | 233 | Знайдений в м'язових Z-смугах, необхідних для розвитку кардіоміоцитів. Утворює комплекс з Rac/Cdc42, забезпечуюючи зв'язування кінази DMPK, в епітеліальних клітинах. Також зв'язує і GOLPH3 в комплексі Гольджі, сприяючи брунькуванню мікропухирців. Може бути пов'язаний із процесами гемопоезу стромальних клітин в кістковому мозку.
Не має консервативних послідовностей для зв'язування актину в домені двигуна, але містить актин-зв'язуючий сайт в «хвості» (АТФ незалежний). |
|
| Міозин 19 | 109 | Рух мітохондрій |
Джерела
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. с. 1011—1013. ISBN 978-0-8153-4105-5.
- Comprehensive Biotechnology (Second Edition) Editor-in-Chief: Murray Moo-Young Copyright © 2011 Elsevier B.V ISBN 978-0-08-088504-9