Пентозофосфатний шлях
Пентозофосфатний шлях (ПФШ, гексозомонофосфатний шунт, фосфоглюконатний шлях) — метаболічний шлях перетворення глюкози, потрібний для отримання відновних еквівалентів НАДФH, що використовуються у процесах біосинтезу багатьох речовин, зокрема жирних кислот та холестерину, та рибозо-5-фосфату, який є важливим попередником в утворенні нуклеотидів. Відбувається у цитоплазмі клітин прокаріот, грибів, рослин та тварин.
У фотосинтезуючих організмів пентозофосфатний шлях має багато спільних ферментів із циклом Кальвіна[1].
Історія дослідження
Перші свідчення про існування пентозофосфатного шляху отримав Отто Варбург у 1930-х роках. Він вивчав окиснення глюкозо-6-фосфату до 6-фосфоглюконату і відкрив НАДФ+. Подальші спостереження показали, що клітинне дихання продовжується навіть у присутності високих концентрацій флюоридів, попри те, що ці сполуки інгібують фермент енолазу, блокуючи гліколіз. У 1950-х роках Френк Дікенс, Бернард Горекер, Фріц Ліпманн та Ефраїм Рекер описали пентозофосфатний шлях[2].
Біологічне значення і локалізація
ПФШ відбувається у цитозолі клітин[3][4], він має кілька біологічних функцій. Однією з них є продукування рибозо-5-фосфату, що використовується для синтезу нуклеотидів, які входять до складу РНК та ДНК, а також коферментів, таких як АТФ, НАД, ФАД, кофермент А. Через це ПФШ активно функціонує у клітинах, що швидко діляться: кісткового мозку, шкіри, слизової оболонки кишківника, а також пухлин[5][6].
Інші моносахариди, що утворюються у ПФШ також можуть використовуватись клітинами, наприклад, у багатьох мікроорганізмів еритрозо-4-фосфат включається у метаболічні шляхи біосинтезу ароматичних амінокислот та вітаміну B6. Рибулозо-5-фосфат може перетворюватись до рибулозо-1,5-бісфосфату, який є акцептором вуглекислого газу у процесі фотосинтезу. Бактерії, що ростуть на середовищі багатому пентозами, використовують пентозофосфатний шлях з метою отримання гексоз, наприклад глюкози необхідної для синтезу пептидоглікану[7].
В багатьох тканинах найбільше значення серед продуктів ПФШ мають не моносахариди, а НАДФH, необхідного у процесах відновного біосинтезу та для подолання шкідливого впливу активних форм кисню. Ферменти цього метаболічного шляху дуже поширені у тканинах, де інтенсивно відбувається біосинтез жирних кислот (печінка, молочні залози під час лактації, жирова тканина) або холестерину та інших стероїдів (печінка, статеві залози, кора наднирників)[5]. Наприклад, було встановлено, що 30 % окиснення глюкози у печінці відбувається за пентозофосфатним шляхом[2].
ПФШ також активно протікає у клітинах, що постійно перебувають у прямому контакті з киснем: еритроцитах та клітинах рогівки і кришталика. Тут він потрібний для підтримання відновного середовища (високого співвідношення НАДФH/НАДФ+ та відновлений глутатіон/окиснений глутатіон), яке може протидіяти окисному ушкодженню ненасичених жирних кислот (перикисному окисенню ліпідів), білків та інших чутливих молекул[5][8].
Реакції пентозофосфатного шляху
Загальна реакція пентозофосфатного шляху має такий вигляд:
3 Глюкозо-6-фосфат + 6 НАДФ+ + 3 H2O → 6 НАДФH(H+) + 3 CO2 + 2 фруктозо-6-фосфат + гліцеральдегідфосфат;
Пентозофосфатний шлях розділяють на дві стадії[3][9][4]:
- Оксинювальна, в ході якої глюкозо-6-фосфат дегідрогенізується та декарбоксилюється з утворенням НАДФH та рибулозо-5-фосфату, що ізомеризується до рибозо-5-фосфату;
- Неокиснювальна, в реакціях якої рибулозо-5-фосфат перетворюється до проміжних продуктів гліколізу.
Деякі автори виділяють у пентозофосфатному шляху три етапи поділяючи неокиснювальну стадію на дві:
- Реакції ізомеризації та епімеризації, в яких рибулозо-5-фосфат перетворюється у рибозо-5-фосфат та ксилулозо-5-фсофат;
- Серія реакцій розщеплення і утворення C-C зв'язків, в результаті яких дві молекули ксилулозо-5-фосфату та молекула рибозо-5-фосфату перетворюються до двох молекул фруктозо-6-фосфату та однієї молекули гліцеральдегід-3-фосфату[2].
Всі реакції неокиснювальної стадії є оборотними, тому загальний вихід пентозофосфатного шляху дуже різниться в залежності від потреб клітини. Наприклад, коли є необхідність у великій кількості рибозо-5-фосфату, стадія 3 діє у зворотному порядку, тобто продукує цю речовину із фруктозо-6-фосфату та гліцеральдегід-3-фосфату[10].
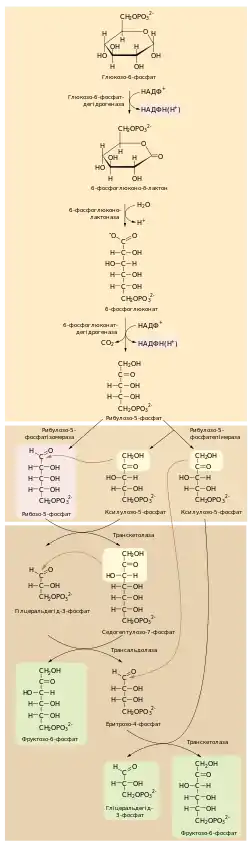
Окисні реакції пентозофосфтаного шляху
Перша реакція пентозофосфтаного шляху — окиснення глюкозо-6-фосфату до внутрішньомолекулярного естеру 6-фосфоглюконо-δ-лактону, що відбувається внаслідок перенесення гідрид іона на НАДФ+. Каталізує цей процес фермент глюкозо-6-фосфатдегідрогеназа, що сильно інгібується відновленим НАДФH[11][5]. Фермент високоспецифічний до НАДФ+, константа Міхаеліса для НАД+ приблизно у 1000 раз вища ніж для НАДФ+[4].
Наступний крок — гідроліз 6-фосфоглюконо-δ-лактону до 6-фосфоглюконату — каталізується 6-фосфоглюконолактоназою. Продукт цієї реакції далі підлягає окисному декарбоксилюванню за участі ферменту 6-фосфоглюконатдегідрогенази, внаслідок чого утворюється вуглекислий газ та рибулозо-5-фосфат[11].
Отже на цій стадії пентозофосфтаного шялху на кожну молекулу глюкозо-6-фосфату, що вступає в нього відновлюються дві молекули НАДФ+[11].
У деяких тканинах ПФШ закінчується реакцією перетворення рибулозо-5-фосфату до рибозо-5-фосфату і має загальне рівнння:
- Глюкозо-6-фосфат + 2НАДФ+ + H2O → рибозо-5-фосфат + НАДФH(H+) + CO2[9]
Проте часто рибулозо-5-фосфат перетворюється у серії реакцій до проміжних продуктів гліколізу.
Неокиснювальна стадія ПФШ
Утворений у першій стадії петозофосфатного шляху рибулозо-5-фосфат далі може підлягати дії ферменту фосфопентоізмоерази (рибулозо-5-фосфатізомерази), що перетворює його у рибозо-5-фосфат, або фосфопентоепімерази (рибулозо-5-фосфатепімерази), яка здійснює реакцію утворення ксилулозо-5-фосфату. Обидві реакції відбуваються через енедіолатні проміжні сполуки[11].
Рибозо-5-фосфат необхідний для синтезу нуклеотидів, проте, коли в клітині його продукується більше ніж потрібно, він разом із ксилулозо-5-фосфатом перетворюється у проміжні продукти гліколізу (фруктозо-6-фосфат та гліцеральдегід-3-фосфат). Перетворення трьох C5 моносахаридів до двох C6 та одного C3 відбувається завдяки ферментам транскетолазі та трансальдолазі. Вони мають схожий механізм дії, що полягає у генеруванні стабілізованого карбаніону та його приєднання до електрофільного центру, такого як альдегідна група[11].
Транскетолаза каталізує перенесення C2 фрагменту від ксилулозо-5-фосфату до рибозо-5-фосфату, внаслідок чого утворюється гліцеральдегід-3-фосфат та седогептулозо-7-фосфат. Як кофактор використовується тіамінпірофосфат[11].
Трансальдолазна реакція полягає у перенесенні C3 фрагменту із седогептулозо-7-фосфату на гліцеральдегід-3-фосфат з утворенням фруктозо-6-фосату та еритрозо-4-фосфату[12].
Наступну реакцію знову каталізує транскетолаза, що переносить C2 фрагмент із ще однієї молекули ксилулозо-5-фосфату на еритрозо-4-фосфат. Продуктами є друга молекула фруктозо-6-фосфату та гліцеральдегід-3-фосфат[12].
Фруктозо-6-фосфат може знову перетворюватись у глюкозо-6-фосфат фосфогексозоізмеразою, гліцеральдегід-3-фосфат також може використовуватись на відновлення глкюкозо-6-фосфату як у глюконеогенезі. В такому випадку одна молекула глюкозо-6-фосфату за 6 циклів пентозофосфатного шляху повністю перетворюється у вуглекислий газ, що супроводжується синтезом 12 молекул відновленого НАДФ[13]. Загальне рівняння процесу матиме такий вигляд:
- Глюкозо-6-фосфат + 12НАДФ+ + 7H2O → 6CO2 + 12НАДФH(H+) + Фн[7].
Регулювання пентозофосфатного шляху
Глюкозо-6-фосфат може вступати як у гліколіз, так і в пентозофосфатний шлях, його розподіл між цими двома шляхами залежить від концентрації НАДФ+, яка впливає на швидкість першої реакції ПФШ. Дегідрогенізація глюкозо-6-фосфату є незворотною і лімітуючою стадією, вона інгібується низькими концентраціями НАДФ+ потрібного як акцептор електронів[14]. Коли клітина активно використовує НАДФH, рівень НАДФ+ зростає і він алостерично активує глюкозо-6-фосфатдегідрогеназу[15].
Швидкість неокиснювальної стадії ПФШ в основному регулюється доступністю субстратів[14].
Протікання пентозофосфатного шляху та його зв'язок із гліколізом і глюконеогензом сильно залежить від потреб клітини у конкретний момент. Можливі чотири ситуації:
| Потреба у рибозо-5-фосфаті значно перевищує потребу в НАДФH | |
|---|---|
 |
Відбувається так званий відновний пентозофосфатний шлях. Майже весь глюкозо-6-фосфат вступає у гліколіз, де перетворюється до фруктозо-6-фосфату та гліцеральдегід-3-фосфату, які в реакціях зворотних до неокиснювальної стадії ПФШ використовуються для синтезу рибозо-5-фосфату[14]. Так було показано, що у ракових клітинах, які швидко діляться, понад 70% de novo синтезу рибози відбувається цим неокисним шляхом[13]. |
| Приблизно однакові потреби у НАДФH та рибозо-5-фосфаті | |
 |
Глюкозо-6-фосфат вступає в окисну стадію ПФШ і перетворюється до рибозо-5-фосфату, що супроводжується відновленням двох молекул НАДФ+[16]. |
| Потреба у НАДФH значно більша ніж у рибозо-5-фосфаті | |
 |
Активно працює окиснювальна і неокиснювальна стадії ПФШ, продукти останньої (фруктозо-6-фосфат та гліцеральдегід-3-фосфат) використовуються для регенерації глюкозо-6-фосфату завдяки ферментам глюконеогенезу. Отже глюкозо-6-фосфат повністю окиснюється до вуглекислого газу[1]. |
| Велика потреба у НАДФH та АТФ, низька у рибозо-5-фосфаті | |
 |
Фруктозо-6-фосфат та гліцеральдегід-3-фосфат утворені в неокиснювальній стадії ПФШ можуть вступати в гліколіз і перетворюватись до пірувату. Корисними продуктами такого шляху є АТФ та НАДФH[1]. |
Нестача ферменту глюкозо-6-фосфатдегідрогенази
Найпоширенішим серед усіх метаболічних захворювань людини є нестача першого ферменту пентозофосфатного шляху — глюкозо-6-фосфатдегідрогенази. Знижений рівень цього ензиму спостерігається у понад 400 мільйонів людей по всьому світу, проте переважно ця аномалія ніяк не проявляється. Клінічні симптоми у формі руйнування еритроцитів, що супроводжується жовтяницею та в деяких випадках нирковою недостатністю, з'являються тільки коли хвора особа стає об'єктом впливу певних факторів середовища[17]. Наприклад, у 1926 році для лікування малярії був запропонований новий препарат — памахін, більшість пацієнтів переносили його нормально, але в невеликої частини з'являлись загрозливі для життя симптоми пов'язані із руйнуванням еритроцитів. Через 30 років було з'ясовано, що гемолітична анемія у відповідь на дію памахіну виникала у людей із нестачею глюкозо-6-фосфатдегідрогенази[18].
Симптоми, схожі до тих, що виникають під впливом протималярійних препаратів, у людей із нестачею глюкозо-6-фосфатдегідрогенази можуть викликатись і вживанням кінських бобів, захворювання, що виникає при цьому, називається фавізм. Відомо, що грецький філософ Піфагор забороняв своїм послідовникам їсти боби[17].
Протималярійні препарати, такі як памахін та примахін, пуриновий глікозид віцин із кінських бобів, деякі сульфаніламідні препарати та гербіциди діють за однаковим принципом — викликають оксидативний стрес, шляхом збільшення рівня активних форм кисню. Особливо чутливі до такого впливу є еритроцити, оскільки в них відсутні мітохондрії, проте в червоних кров'яних тільцях здорової людини згубний ефект активних форм кисню елімінується завдяки відновленому глутатіону. Щоб регенерувати відновлений глутатіон із його окисненої форми, необхідний НАДФH, який утворюється глюкозо-6-фосфатдегідрогеназою в першій реакції пентозофосфатного шляху. В осіб із зниженим рівнем цього ферменту еритроцити не мають ефективного захисту проти оксидативного стресу, і тому руйнуються під впливом згаданих речовин[17].
Оскільки до активних форм кисню дуже чутливим є також і клітини малярійного плазмодія, нестача глюкозо-6-фосфатдегідрогенази також забезпечує стійкість проти одного із видів цього паразита — Plasmodium falciparum. Про це свідчить поширення метаболічного захворювання: воно найбільш розповсюджене у тропічній Африці, на Середньому Сході та у Південносхідній Азії, де спостерігаються найвищі рівні захворювання малярією[17].
Примітки
- Berg et al, 2007, с. 585.
- Voet et al, 2011, с. 892.
- Губський, 2007, с. 201.
- Berg et al, 2007, с. 577.
- Nelson et al, 2008, с. 558.
- Губський, 2007, с. 206.
- Prescott, 2002, с. 177.
- Губський, 2007, с. 208.
- Nelson et al, 2008, с. 560.
- Voet et al, 2011, с. 893.
- Voet et al, 2011, с. 894.
- Voet et al, 2011, с. 895.
- Voet et al, 2011, с. 897.
- Berg et al, 2007, с. 583.
- Nelaon et al, 2008, с. 563.
- Berg et al, 2007, с. 584.
- Nelson et al, 2008, с. 559.
- Berg et al, 2007, с. 586.
Джерела
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5.
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1.
- Prescott L.M. (2002). Microbiology (вид. 5th). McGraw−Hill. ISBN 0-07-282905-2.
- Voet D., Voet J.G. (2011). Biochemistry (вид. 4th). Wiley. с. 487—496. ISBN 978-0470-57095-1.
- Губський Ю.І. (2007). Біологічна хімія. Київ-Вінниця: Нова книга. с. 656. ISBN 978-966-382-017-0.
