Рентгеноструктурний аналіз
Рентгенострукту́рний ана́ліз — метод дослідження структури речовини, в основі якого лежить явище дифракції рентгенівського випромінювання на тривимірних кристалічних ґратках.
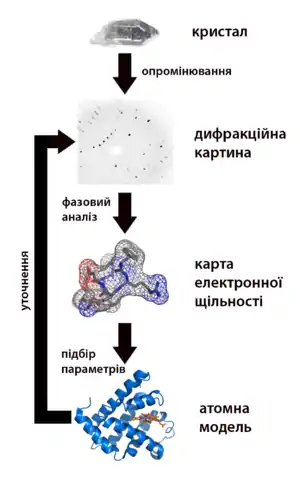
Загальний опис
Для дослідження атомної структури застосовують випромінювання з довжиною хвилі близько 1 Å, тобто, розмірів атомів. Разом із нейтронографією і електронографією метод належить до дифракційних методів дослідження структури речовини.
Метод дозволяє визначати атомну структуру речовини, що включає просторову групу елементарної комірки, її розміри і форму, а також визначити групу симетрії кристалу. За допомогою методу можна досліджувати метали і їх сплави, мінерали, неорганічні і органічні сполуки полімери, аморфні матеріали, рідини і гази, молекули білків, нуклеїнових кислот та інші речовини. Найлегшим і найуспішнішим є застосовування методу для встановлення атомної структури кристалічних тіл, які вже мають строгу періодичність будови і фактично є створеними природою дифракційними ґратками для рентгенівських променів. Для решти речовин кристал повинен бути створеним, що є важливою і складною частиною методу рентгеноструктурного аналізу.
Факт явища дифракції рентгенівських променів на кристалах відкритий Лауе, теоретичне обґрунтування явищу дали Вульф і Брегг (умова Вульфа-Брегга). Як метод рентгеноструктурний аналіз розроблений Дебаєм і Шеррером. Рентгеноструктурний аналіз і до цього дня залишається одним з найпоширеніших методів визначення структури речовини через його простоту і відносну дешевизну.
Історія методу
Дифракція рентгенівських променів на кристалах була відкрита в 1912 році німецькими фізиками Максом фон Лауе, Вільямом Фридріхом і Паулем Кніппінгом. Направивши вузький пучок рентгенівських променів на нерухомий кристал, вони зареєстрували на поміщеній за кристалом фотопластині дифракційну картину, яка складалася з великого числа регулярно розташованих плям. Кожна пляма — слід дифракційного променя, розсіяного кристалом. Рентгенограма, отримана таким методом, пізніше отримала назву лауеграми.
Розроблена Лауе теорія дифракції рентгенівських променів на кристалах дозволила зв'язати довжину хвилі випромінювання за параметрами елементарної комірки кристалу. Фактично було показано, що дифракційна картина кристалу являє собою перетворення Фур'є його двомірної проекції. У 1913 році Лоренс Брегг і одночасно з ним Г. В. Вульф запропонували наочніше трактування виникнення дифракційних променів в кристалі. Вони показали, що дифракційні промені можна розглядати як віддзеркалення падаючого променя від однієї з систем кристалографічних площин (дифракційне віддзеркалення або умова Брегга — Вульфа).
У тому ж році Лоренс Брегг разом із своїм братом Генрі Бреггом вперше дослідили атомні структури простих кристалів за допомогою рентгенівських дифракційних методів. У 1916 році американський фізик Петер Дебай і німецький Пауль Шеррер запропонували використання дифракції рентгенівських променів для дослідження структури полікристалічних матеріалів. У 1938 французький кристалограф Андре Гіньє розробив метод рентгенівського малокутового розсіяння для дослідження форми і розмірів неоднорідностей в речовині.
Можливість використання рентгеноструктурного аналізу для дослідження широкого класу речовин та велика цінність цих досліджень стимулювали розвиток методів розшифровки структур. У 1934 році американський фізик Артур Патерсон запропонував досліджувати будову речовин за допомогою функції міжатомних векторів (функції Патерсона). Американські учені Девід Харкер, Джон Каспер (1948), Вільям Захаріасен, Девід Сейр і англійський учений Вільям Кокрен (1952) заклали основи так званих прямих методів визначення кристалічних структур. Роботи з дослідження просторової структури білків, розпочаті в 30-х роках у Великій Британії Джоном Берналом і успішно продовжені Джоном Кендрю, Максом Перуцем та іншими зіграли важливу роль в становленні молекулярної біології. У 1953 році дані рентгенострустурного аналізу, отримані Морісом Вілкінсом і Розаліндою Франклін дозволили Джеймсу Ватсону і Френсісу Кріку створити модель молекули дезоксирибонуклеїнової кислоти. З 50-х років почали бурхливо розвиватися методи обробки дифракційної інформації і аналізу цих даних за допомогою комп'ютерів. В Україні в Донецькому національному технічному університеті на кафедрі «Прикладна екологія та охорона навколишнього середовища» професор Масляєв Віктор Семенович створив сучасну лабораторію рентгеноструктурного аналізу.
Методи
Кристалізація

Хоча рентгеноструктурний аналіз може використовуватися для характеристики розташування атомів в забрудненому або невпорядкованому кристалі, загалом для точного визначення структури метод вимагає кристалу дуже високого рівня впорядкованості. Чисті впорядковані кристали іноді формуються мимовільно в природних або штучних матеріалах, наприклад металах, мінералах та інших макроскопічних речовинах. Регулярність таких кристалів іноді може бути вдосконалена за допомогою відпалу та інших методів. Проте, в багатьох випадках, отримання якісного придатного для дифракції кристалу є головним бар'єром для визначення його структури на атомному рівні[1].
Зазвичай рентгеноструктурний аналіз поділяється на аналіз малих молекул і макромолекул, перш за все через різні методи, що використовуються для отримання якісних кристалів. Малі молекули загалом мають небагато ступенів конформаційної свободи і можуть бути кристалізовані за допомогою широкого набору методів, наприклад вакуумного нанесення і рекристалізації. На відміну від них, макромолекули загалом мають багато ступенів свободи і їхня кристалізація повинна здійснюватися за умовами точного збереження структури. Наприклад, молекули білків та РНК не можуть бути кристалізовані, якщо їх третинна структура розгорнута, тому методи кристалізації обмежені умовами збереження нативного стану таких макромолекул.
Кристали білків та інших макромолекул майже завжди вирощуються в розчині. Найзагальніший підхід — поступове зниження розчинності його компонентів, якщо ж це робиться швидко, молекули преципітують з розчину, формуючи аморфний осад на дні посудини. Ріст кристалів в розчині характеризується двома стадіями: нуклеація, тобто утворення мікроскопічного ядра кристалу (що має лише близько 100 молекул), та росту цього ядра до розмірів, необхідних для аналізу[2]. Умови розчину, найкращі для першої стадії (нуклеації), — не завжди найкращі й для другої (росту кристалу). Таким чином, мета кристалографів — створити умови, найкращі для росту одного великого кристалу, тому що великий розмір дозволяє покращити якість методу. Зазвичай умови підбираються несприятливими для нуклеації, але сприятливими для росту кристалу, таким чином перший кристал поглине більшість матеріалу з розчини, не залишаючи можливості виникнення численних мікрокристалів. В деяких випадках кристалографам вдається підібрати умови утворення лише дуже малих кристалів. В такому випадку один з таких кристалів переноситься до іншої посудини, де він може продовжити ріст. В деяких випадках, великі кристали можуть розбиваються для отримання невеликих фрагментів, що знову вирощуються для отримання кристалів вищої якості.
Надзвичайно важко передбачити умови, оптимальні для росту ідеально впорядкованих кристалів[3]. На практиці, сприятливі умови часто встановлюються за допомогою скринінгу — приготування великої кількості досліджуваної речовини і випробування широкої різноманітності умов кристалізації, часто сотні або навіть тисячі[4]. Для кристалізації різних молекул використовуються різні фізичні механізми зниження розчинності, наприклад зміна pH, додавання солей гофмейстерівської серії або речовин, що знижують діелектричну проникність розчину або великих полімерів, також як поліетиленгліколь, що виводять молекулу поза фазу розчину через ентропійний ефект. Часто випробуються різні температури для підбору швидкості кристалізації або для створення перенасиченого розчину. Ці методи вимагають великої кількості досліджуваної речовини високого рівня очищення, які, наприклад, у випадку білків, часто буває важко отримати. Для економії речовини були розроблені роботи, здатні розділяти малі кількості речовини, близько 100 нанолітрів, що дозволяє зменшити витрати речовини[5].
Відомо декілька чинників, що перешкоджають кристалізації. Наприклад, кристали загалом тримають при постійній температурі і захищають від вібрацій, які перешкоджали б отриманню якісного кристалу. Домішки в розчині часто ворожі до кристалізації. Конформаційна гнучкість в молекулі також прагне зменшити ймовірність утворення упорядкованого кристалу. Цікаво, що речовини, здатні до само збірки у регулярні структури, часто несхильні збиратися у кристали. Кристали можуть псуватися сполученням кількох центрів кристалізації, хоча сучасні обчислювальні методи здатні отримувати структуру деяких з таких кристалів. Часто якщо кристалізація не вдається для якоїсь речовини, кристалограф пробує дещо модифіковану молекулу, навіть дрібниці в молекулярних властивостях можуть призводити значної різниці у властивостях її кристалізації.
Джерела випромінювання

Для опромінювання кристала потрібне монохроматичне джерело рентгенівського випромінювання. Найяскравіші і найкорисніші джерела рентгенівського випромінювання — синхротрони, велика яскравість їх світла дозволяє отримання найкращої роздільної здатності. Вони також зручні для регулювання довжини хвилі випромінювання, що корисно, на приклад, для фазового аналізу за допомогою методу багатохвильової аномальної дисперсії (MAD), описаного нижче. Синхротрони зазвичай дуже коштовні та існують тільки в державних наукових центрах, де вони використовуються кожну хвилину дня і ночі.
У лабораторіях використовуються менші та слабші джерела рентгенівського випромінювання, зазвичай для перевірки якості кристалів перед проведенням досліджень за допомогою синхротрону та для отримання грубого аналізу речовини. У таких системах, електрони вилітають з катоду і прискорюються за допомогою електричного потенціалу близько 50 кВ, після чого бомбардують металеву пластину, що приводить для отримання гальмівного випромінювання і рекомбінаційного випромінювання у вигляді кількох сильних спектральних ліній, що відповідають збудженню електронів внутрішніх орбіталей атому металу. Як матеріал цієї пластинки найзагальніше використовуваний мідь, яку легко охолоджувати через її високу теплопровідність, отримуючи яскраві лінії Kα and Kβ. Лінія Kβ іноді видаляється за допомогою тонкого шару (0,01 мм) нікелевої фольги. Ці джерела дають близько 2 кВт випромінювання в звичайнісінькому варіанті і, приблизно, до 14 кВт у найдорожчих варіантах.
Отримане рентгенівське випромінювання зазвичай фільтрується для отримання єдиної довжини хвилі (монохроматичного випромінювання) і колімується перед подачею на кристал. Фільтрування не тільки спрощує аналіз даних, але і усуває випромінювання, яке погіршує кристал без додавання корисної інформації. Колімація робиться або за допомогою коліматору (зазвичай довгої металевої трубки), або певним розташуванням слабо викривлених дзеркал. Дзеркальним системам віддається перевага для маленьких кристалів (до 0,3 мм) або з кристалам з великим розміром кристалічної чарунки (понад 150 Å).
Метод Лауе
У методі Лауе вузький (немонохроматичний) пучок рентгенівських променів (чи нейтронів) направляється на нерухомо закріплений монокристалічний зразок. Цей пучок містить рентгенівські промені з набором довжин хвиль у широкому інтервалі значень. У кристалі відбувається «відбір», і дифрагує тільки випромінювання з дискретним набором довжин хвиль λ, таких, що для цих довжин хвиль міжплощинні відстані d і кути падіння θ задовольняють закону Брега. Метод Лауе надзвичайно зручний для швидкого визначення симетрії кристала і його орієнтації. Він використовується також для визначення розмірів спотворень і дефектів, що виникають у кристалі при механічній і термічній обробці.
Схема камери Лауе. Джерело рентгенівських променів випускає випромінювання, що має суцільний спектр, з довжинами хвиль, наприклад, від 0,2Å до 2Å. Система діафрагм дозволяє отримати добре напрямлений пучок. Розміри монокристалу можуть не перевищувати 1 мм. Плоска рентгенівська плівка розташовується так, що на неї попадають або прохідні, або відбиті дифраговані промені. Дифракційна картина складається із серії плям (рефлексів); на мал. 2 показана дифракційна картина для кремнію. Кожна площина кристала, що відбиває, вибирає з падаючого пучка випромінювання з тією довжиною хвилі, що задовільняє закон Брега 2dsinθ=пλ. Одержувана дифракційна картина характеризує симетрію кристала: наприклад якщо кристал, що має вісь симетрії четвертого порядку, орієнтований так, що ця вісь паралельна падаючому пучку, то лауеграма також буде мати вісь симетрії четвертого порядку, Лауеграми широко використовуються для орієнтації кристалів при експериментальному вивченні різних твердих тіл.
Метод Лауе практично ніколи не застосовується для визначення кристалічної структури. Справа в тім, що та сама атомна площина може давати кілька зображень різних порядків, тому що для отримання лауеграм використовується широкий інтервал значень довжин хвиль; тому окремі плями на лауеграмі можуть виявитися результатом накладання зображень різних порядків. Це ускладнює визначення інтенсивності даного відбивання, що, у свою чергу, ускладнює визначення базису.
Методи дослідження полікристалів
Дослідження вугільної речовини
Рентгенівська дифрактометрія проводиться під великими, під середніми і під малими (<6о) кутами.
Параметри молекулярної структури вугілля визначаються за результатами зйомки під великим і середніми кутами. Розраховується між'ядерна відстань (d002), розміри ароматичного ядра (La), товщина пакету (Lc) і текстура (орієнтація) Т. Зйомки під малими кутами дозволяють розраховувати поздовжні (LII) і поперечні (Lo) розміри надмолекулярних утворень, розміри і форму молекулярних пор і об'єм середньої мікропори. Крім того, за даними рентгенівських зйомок можна визначити склад і кількість мінеральних складових.[6]
Примітки
- Geerlof A, Brown J, Coutard B, Egloff MP, Enguita FJ, Fogg MJ, Gilbert RJ, Groves MR, Haouz A, Nettleship JE, Nordlund P, Owens RJ, Ruff M, Sainsbury S, Svergun DI, Wilmanns M (2006). The impact of protein characterization in structural proteomics. Acta Crystallogr. D Biol. Crystallogr. 62 (Pt 10): 1125–36. PMID 17001090.
- Chernov AA (2003). Protein crystals and their growth. J. Struct. Biol. 142 (1): 3–21. PMID 12718915.
- Rupp B, Wang J (2004). Predictive models for protein crystallization. Methods 34 (3): 390–407. PMID 15325656.
- Chayen NE (2005). Methods for separating nucleation and growth in protein crystallization. Prog. Biophys. Mol. Biol. 88 (3): 329–37. PMID 15652248.
- Stock D, Perisic O, Lowe J (2005). Robotic nanolitre protein crystallisation at the MRC Laboratory of Molecular Biology.. Prog Biophys Mol Biol 88 (3): 311–27. PMID 15652247.
- Саранчук В. И., Айруни А. Т., Ковалев К. Е. Надмолекулярная организация, структура и свойства углей. — Киев: Наукова думка, 1988. — 191 с.
Джерела
- З.Г. Пинскер. Рентгеновская кристаллоптика. Москва. Наука. 1982.