Трастузумаб емтанзин
Трастузумаб-емтанзин [1][2] також відомий як адо-трастузумаб-емтанзин продається під торговою назвою Кадцила (Kadcyla), являє собою кон'югат антитіла з лікарським засібом, що складається з людського моноклонального антитіла трастузумаб (Herceptin), ковалентно пов'язаного з цитотоксичним агентом DM1 .[3][4] Сам трастузумаб зупиняє ріст ракових клітин шляхом зв'язування з рецептором HER2, тоді як трастузумаб-емтанзин проходить рецептор-опосередковану інтерналізацію (проникнення) в клітини, катаболізується в лізосомах, де вивільняються DM1-вмісні катаболіти, які зв'язується з тубуліном, що викликає зупинку мітозу та загибель клітин.[5] Зв'язування трастузумабу з HER2 запобігає гомодимеризації або гетеродимеризації (HER2/HER3) рецептора, інгібуючи активацію клітинних сигнальних шляхів MAPK і PI3K/AKT. Оскільки моноклональне антитіло націлено на HER2, а HER2 експресується лише в ракових клітинах, кон'югат доставляє цитотоксичний агент DM1 конкретно до пухлинних клітин.[6] Кон'югат скорочено позначається T-DM1.
 | |
|---|---|
Трастузумаб емтанзин
| |
| Систематизована назва за IUPAC | |
| Класифікація | |
| ATC-код | L01 |
| PubChem | |
| CAS | |
| DrugBank | |
| Хімічна структура | |
| Формула | C6448H9948N1720O2012S44·(C47H62ClN4O13S)n |
| Мол. маса | |
| Синоніми | ado-trastuzumab emtansine, trastuzumab-DM1, T-DM1 |
| Фармакокінетика | |
| Біодоступність | |
| Protein binding | 93% (in vitro) |
| Метаболізм | печінковий |
| Період напіввиведення | |
| Екскреція | |
| Реєстрація лікарського засобу в Україні | |
У клінічному дослідженні EMILIA за участі жінок із зрілим HER2-позитивним (HER2+) раком молочної залози, які вже були резистентними до трастузумабу, спостерігалося покращення середньої загальної виживаності на 5,8 місяця (30,9 місяців проти 25,1 місяця) порівняно з комбінацією лапатиніб та капецитабін.[6] Виходячи з цього дослідження, 22 лютого 2013 року Управління з продовольства і медикаментів США (FDA) ухвалило дозвіл на продаж препарату.[7][8]
Трастузумаб емтанзин був розроблений компанією Genentech, дочірньою структурою групи Roche, і виробляється компанією Lonza .[9] Очікувана вартість - 9 800 доларів на місяць, або 94 000 доларів за звичайний курс лікування.[7]
Медичне використання
У США адо-трастузумаб емтанзин був схвалений тільки для лікування HER2+ метастатичного раку молочної залози (mBC), у пацієнтів, які раніше отримували лікування трастузумабом та таксаном (паклітаксел або доцетаксел) та які вже лікувались від mBC або у яких розвинувся рецидив пухлини протягом шести місяців ад'ювантної терапії .[10][11]
Ухвалення було засновано на клінічному дослідженні фази ІІІ EMILIA , у якому порівнювали трастузумаб емтанзин та капецитабін (Кселода) плюс лапатініб (Тикерб) у 991 учасника з неоперабельним, місцево-поширеним або метастатичним HER2+ раком молочної залози, які раніше отримували хіміотерапію трастузумабом та таксаном. Це дослідження показало покращену виживаність без прогресїї хвороби у пацієнтів, які отримували трастузумаб емтанзин (медіанний показник 9,6 місяця проти 6,4), а також покращення загальної виживаності (30,9 місяця проти 25,1) та меншу кількість побічних ефектів.[6]
Клінічні дослідження
З 2013 року було проведено ще кілька клінічних випробувань:
- Лікування (перша лінія) метастатичного раку молочної залози: дослідження MARIANNE , у якому порівнювали таксан (доцетаксел або паклітаксел) плюс трастузумаб, T-DM1 та T-DM1 плюс пертузумаб, у якості лікування першої лінії для людей з HER2+ неоперабельним місцевопрогресивним або метастатичним раком молочної залози. 19 грудня 2014 року група Рош повідомила про результати дослідження MARIANNE: лікування, що включало Кадцилу, значуще не покращувало виживання без прогресії хвороби порівняно з Герцептином та хіміотерапією.[12]
- дослідження фази ІІІ при HER2+ раку шлунку, де порівнювали T-DM1 з таксаном (доцетаксел або паклітаксел, обирав лікар). 22 жовтня 2015 року Рош та співавтор ImmunoGen показали, що у групі Кадцили не було досягнуто первинної кінцевої точки у дослідженні фази II/III GATSBY, у якому вивчалося лікування (друга лінія) пізніх стадій HER2+ раку шлунка.[13]
- У дослідженні TH3RESA порівнювали T-DM1 з лікуванням, яке обирав лікар у пацієнтів з HER2+ метастатичним раком молочної залози, які раніше отримували трастузумаб та лапатиніб. Проміжні результати TH3RESA свідчать про подвоєння строків виживання без прогресії з трьох до шести місяців.[14]
Побічні ефекти
Під час клінічних досліджень найпоширенішими побічними ефектами трастузумаб емтанзину були втома, нудота, м'язово-скелетний біль, тромбоцитопенія, головний біль, підвищення рівня ферментів печінки та закрепи.[11]
Серйозні побічні ефекти, виявлені під час дослідження EMILIA, включали гепатотоксичність (ураження печінки), зокрема рідкісні випадки печінкової недостатності, печінкову енцефалопатію та вузлову регенеративну гіперплазію; ураження серця (дисфункція лівого шлуночка); інтерстиціальне захворювання легенів, включаючи гострий інтерстиціальний пневмоніт; тромбоцитопенії; та периферичну невропатію.[11] В цілому, трастузумаб емтанзин переносився краще, ніж контрольне лікування: комбінація лапатініб (Tykerb) і капецитабін (Xeloda). У 43 % пацієнтів в групі трастузумабу емтанзину спостерігалися серйозні токсичні ефекти, у порівнянні з 59 % тих, хто отримував лапатініб+капецитабін; крім того, меншій кількості пацієнтів довелося припинити лікування через побічні ефекти, ніж при застосуванні лапатинібу/капецитабіну. Анемія, низький рівень тромбоцитів та периферична нейропатія частіше зустрічаються серед пацієнтів, які отримували трастузумаб емтанзин, тоді як ураження серця та шлунково-кишкові ефекти, такі як блювання, діарея та стоматит, частіше зустрічалися з лапатинібом/капецитабіном.
У США до Кадцили застосовані обрамлені застереження щодо токсичності печінки, ураження серця (зменшення фракції викиду лівого шлуночка) та фетальної токсичності, якщо його дають вагітним.[8][11]
Питання щодо ціни у Великій Британії
У Сполученому Королівстві Кадцила не була рекомендована до використання Національною службою охорони здоров'я, через те, що з Рош не вдалося досягти прийнятної цінової угоди.[15] Спочатку препарат коштував 5 900 фунтів на місяць.[16] та у NICE підрахували, що це б коштувало 166 000 фунтів стерлінгів за рік покращення якості життя (QALY) [17] (що значно перевищує звичайний максимум). Лікування фінансувалося Англійським фондом лікарських засобів проти раку, але в січні 2015 року було запропоновано вилучити препарат із затвердженого списку.[18] Після узгодження знижки від Рош, величина якої не розголошується, Фонд продовжить фінансувати лікування.
У червні 2017 року Конфедерація NHS та виконавчий директор NHS Саймон Стівенс оголосили, що NHS буде пропонувати Кадцилу обмеженій кількості жінок після укладання угоди з Рош.[19]
Номенклатура
У 2013 році Кадцила була схвалена у США із загальною назвою "адо-трастузумаб емтанзин" [8][10] а не під оригінальним, наданим у 2009 році, ім'ям (USAN), "трастузумаб емтанзин". Трастузумаб є антитілом проти HER2; емтанзин є препаратом-лінкером (SMCC-DM1). На вимогу FDA було додано префікс "адо-", щоб запобігти лікарським помилкам.[20] Під час доклінічних розробок та клінічних випробувань препарат також був відомий як трастузумаб-DM1 або трастузумаб-MCC-DM1 (через кодове найменування емтанзину), скорочено T-DM1, так і під кодовою назвою PRO132365.[4]
Хімічні властивості
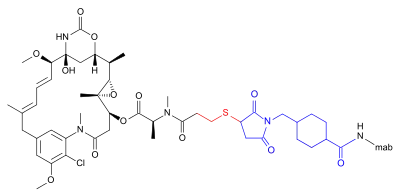
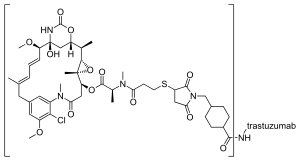
Трастузумаб емтанзин - це кон'югат антитіла та лікарського засобу (ADC), комбінація між моноклональним антитілом та низькомолекулярним препаратом. Кожна молекула трастузумабу емтанзину складається з однієї молекули трастузумабу, поєднаною з декількома молекулами DM1 і цитотоксичною речовиною мейтанзиноїдом.[21] SMCC, або сукцинімідил транс -4-(малеїмідилметил)циклогексан-1-карбоксилат, є гетеробіфункціональним крослінкером, типом хімічного реагенту, що містить дві реакційноздатні функціональні групи: естер сукциніміду та малеїмід. Сукцинімідна група SMCC реагує з вільною аміногрупою залишку лізину в молекулі трастузумабу [відсутнє в джерелі] і малеїмідний фрагмент SMCC пов'язується з вільною сульфгідрильною групою DM1, утворюючи ковалентний зв'язок між антитілом і DM1. Кожна молекула трастузумабу може бути пов'язана з від нуля до вісьмома молекулами DM1 (в середньому 3,5).[22] DM1 зв'язується з плюс-кінцем клітинних мікротрубочок і тим самим інгібує поділ клітин у пухлинних клітинах-мішенях.[23]
Історія
У США амо-трастузумаб-емтанзин було схвалено у 2013 році для лікування дорослих із HER2+ метастатичним раком молочної залози, які раніше отримували трастузумаб і таксан, окремо або в комбінації.[8][10]
Грунтуючись на клінічних дослідженнях T-DM1, адо-трастузумаб-емтанзин був розглянутий в рамках пріоритетної програми FDA.[8]
Безпеку та ефективність адо-трастузумабу емтанзину оцінювали в клінічному дослідженні за участі 991 пацієнта, рандомізованих на прийом адо-трастузумабу емтанзину або лапатинібу плюс капецитабіну, іншого хіміотерапевтичного препарату.[8] Пацієнти отримували лікування, до моменту прогресії раку або до моменту, коли побічні ефекти не ставали нестерпними. У дослідженні вимірювали виживаність без прогресії (тривалість життя до моменту прогресування раку), і загальну виживаність (тривалості життя до смерті).
Дослідження показало, що пацієнти, які отримували адо-трастузумаб емтанзин, мали середню виживаність без прогресії 9,6 місяця порівняно з 6,4 місяця у пацієнтів, які отримували лапатиніб плюс капецитабін.[8] Середня загальна виживаність в групі адо-трастузумаб емтанзин становила 30,9 місяців та 25,1 місяця в групі лапатинібу плюс капецитабін.
У лютому 2013 року FDA схвалила адо-трастузумаб емтанзин і видала компанії Genentech дозвіл на продаж Кадцили.[8]
У 2013 році адо-трастузумаб емтанзин був схвалений для використання у Сполученому Королівстві [24] та ЄС.[25]
У 2019 році в США адо-трастузумаб емтанзин було схвалено для ад’ювантного лікування пацієнтів із HER2+ раком молочної залози на ранній стадії (EBC), які мають залишкову інвазивну хворобу після неоад'ювантного лікування таксаном та лікування на основі трастузумабу.[26]
Схвалення базувалося на рандомізованому, багатоцентровому, відкритому дослідженні KATHERINE (NCT01772472 ) за участі 1486 пацієнтів із HER2+ EBC.[26]
Первинною кінцевою точкою дослідження точкою була виживаність без інвазії, визначена як час від дати рандомізації до першого виникнення іпсилатерального рецидиву інвазивної пухлини молочної залози, іпсилатерального локального або регіонального інвазивного раку молочної залози, віддаленого рецидиву, контралатерального інвазивного раку молочної залози та ін. або смерть з будь-якої причини.[26] Протягом спостереження (медіанний показник 40 місяців) було показано статистично значуще кращу виживаність у пацієнтів, які отримували адо-трастузумаб емтанзин у порівнянні з тими, хто отримував трастузумаб (HR 0,50; 95% ДІ: 0,39, 0,64; p<0,0001).
FDA надала адо-трастузумабу емтазину статус пріоритетного розгляду та статус проривного лікування в якості ад'ювантного лікування пацієнтів із HER2+ раком молочної залози на ранній стадії, які мають залишкову хворобу після передопераційного системного лікування.[26]
Список літератури
- Niculescu-Duvaz I (June 2010). Trastuzumab emtansine, an antibody-drug conjugate for the treatment of HER2+ metastatic breast cancer. Curr. Opin. Mol. Ther. 12 (3): 350–60. PMID 20521224.
- USAN Council (2009). Statement On A Nonproprietary Name Adopted By The Usan Council: Trastuzumab Emtansine. American Medical Association. Процитовано 22 лютого 2013.
- Trastuzumab emtansine: a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer. Clin. Cancer Res. 17 (20): 6437–47. October 2011. PMID 22003071. doi:10.1158/1078-0432.CCR-11-0762. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - Trastuzumab emtansine. National Cancer Institute (NCI). Процитовано 23 лютого 2013.
- The promise of antibody-drug conjugates. N. Engl. J. Med. 367 (19): 1847–8. November 2012. PMID 23134386. doi:10.1056/NEJMe1211736. Проігноровано невідомий параметр
|vauthors=(довідка) - Trastuzumab emtansine for HER2-positive advanced breast cancer. N. Engl. J. Med. 367 (19): 1783–91. November 2012. PMC 5125250. PMID 23020162. doi:10.1056/NEJMoa1209124. Проігноровано невідомий параметр
|vauthors=(довідка) - Pollack, Andrew (22 лютого 2013). F.D.A. Approves a New Drug for Advanced Breast Cancer. The New York Times. Процитовано 22 лютого 2013.
- (прес-реліз). Вказано більш, ніж один
|archivedate=та|archive-date=(довідка); Пропущений або порожній|title=(довідка) Ця стаття містить текст із джерела, яке перебуває в суспільному надбанні.
Ця стаття містить текст із джерела, яке перебуває в суспільному надбанні. - Franklin, Joshua (24 липня 2014). Lonza profit boosted by drug production outsourcing. Reuters. Процитовано 28 липня 2014.
- Drug Approval Package: ado-trastuzumab emtansine. U.S. Food and Drug Administration (FDA). 22 лютого 2013. Архів оригіналу за 4 December 2019. Процитовано 3 грудня 2019.
 Ця стаття містить текст із джерела, яке перебуває в суспільному надбанні.
Ця стаття містить текст із джерела, яке перебуває в суспільному надбанні. - Kadcyla- ado-trastuzumab emtansine injection, powder, lyophilized, for solution. DailyMed. 16 травня 2019. Процитовано 4 грудня 2019.
- Roche provides update on Phase III MARIANNE study in people with previously untreated advanced HER2-positive breast cancer. 2014. Процитовано 16 січня 2015.
- Roche's Kadcyla Fails Phase II/III Trial for Gastric Cancer. Genetic Engineering & Biotechnology News. 22 жовтня 2015. Процитовано 26 травня 2017.
- TDM-1 Heavy Hitter in Heavily Treated Breast Cancer. Oct 2013
- Triggle, Nick (8 серпня 2014). NHS says no to new breast cancer drug Kadcyla. BBC News Online. Процитовано 8 серпня 2014.
- Breast cancer drug Kadcyla to remain on NHS after manufacturer lowers price. Nov 2015
- Pressure grows on Roche to lower breast cancer drug price. Aug 2014
- David Cameron's flagship Cancer Drugs Fund 'is a waste of NHS cash'. Guardian. 10 січня 2015. Процитовано 11 січня 2015.
- NHS U-turn sees breast cancer drug Kadcyla approved for use. NursingNotes (en-GB). 16 червня 2017. Процитовано 16 червня 2017.
- Drug Safety Communication: FDA warns about potential medication errors resulting from confusion regarding nonproprietary name for breast cancer drug Kadcyla (ado-trastuzumab emtansine). U.S. Food and Drug Administration (FDA). 16 січня 2016. Архів оригіналу за 4 December 2019. Процитовано 3 грудня 2019.
 Ця стаття містить текст із джерела, яке перебуває в суспільному надбанні.
Ця стаття містить текст із джерела, яке перебуває в суспільному надбанні. - Clinical pharmacology of trastuzumab emtansine (T-DM1): an antibody-drug conjugate in development for the treatment of HER2-positive cancer. Cancer Chemother. Pharmacol. 69 (5): 1229–40. May 2012. PMC 3337408. PMID 22271209. doi:10.1007/s00280-011-1817-3. Проігноровано невідомий параметр
|vauthors=(довідка) - Targeting HER2-positive breast cancer with trastuzumab-DM1, an antibody-cytotoxic drug conjugate. Cancer Res. 68 (22): 9280–90. November 2008. PMID 19010901. doi:10.1158/0008-5472.CAN-08-1776. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - Antibody-DM1 conjugates as cancer therapeutics. Cancer Letters 307: 113–118. August 2011. PMC 3105156. PMID 21481526. doi:10.1016/j.canlet.2011.03.017. Проігноровано невідомий параметр
|vauthors=(довідка) - Kadcyla 100 mg Powder for Concentrate for Solution for Infusion - Summary of Product Characteristics (SmPC). electronic medicines compendium (emc). 19 листопада 2019. Архів оригіналу за 4 December 2019. Процитовано 3 грудня 2019.
- Kadcyla EPAR. European Medicines Agency (EMA). 17 вересня 2018.
- FDA approves ado-trastuzumab emtansine for early breast cancer (прес-реліз). 6 травня 2019. Вказано більш, ніж один
|archivedate=та|archive-date=(довідка) Ця стаття містить текст із джерела, яке перебуває в суспільному надбанні.
Ця стаття містить текст із джерела, яке перебуває в суспільному надбанні.