PIEZO1
PIEZO1 (англ. Piezo type mechanosensitive ion channel component 1, від грецького "πίεση" (пієзі), що означає "тиск") – білок, який кодується однойменним геном , розташованим у людей на короткому плечі 16-ї хромосоми. [3] Довжина поліпептидного ланцюга білка становить 2 521 амінокислот, а молекулярна маса — 286 790[4].
Кодований геном білок за функцією належить до механочутливих іонних каналів. , що під час активації пропускає (пасивним транспортом) через себе йони Na, K, Ca та Mg, з переважанням Ca[5]. Локалізований у клітинній мембрані, ендоплазматичному ретикулумі, клітинних відростках.
Історія відкриття
В 2010-му році, [6] Coste з співавторами помітили, що нокдаун продуктів гену FAM38A та FAM38B призвів до втрати чутливості до механічних подразнень у клітин нейробластоми лінії N2A. Так був відкритий механочутливий йонний канал Piezo1 та Piezo2.
FAM38A був знайдений в мембрані ендоплазматичного ретикулуму [7], однак таке розміщення білку не може свідчити про його механочутливість. Аби довести наявність цього білку в цитоплазматичній мембрані методом імуногістохімії одночасно зафарбували Piezo1 та TRPA1, про який відоме місце локалізації, та показали їх присутність на одному рівні [6].
Родина механочутливих йонних каналів Piezo
Нещодавно відкрита родина механочутливих йонних каналів Piezo налічує 2 механорецептори, Piezo1 та Piezo2, що були відокремлені через наявність специфічної послідовності - CED-домену, який збігається в 2-х членах родини на 54%[8].
Будова білку
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MEPHVLGAVL | YWLLLPCALL | AACLLRFSGL | SLVYLLFLLL | LPWFPGPTRC | ||||
| GLQGHTGRLL | RALLGLSLLF | LVAHLALQIC | LHIVPRLDQL | LGPSCSRWET | ||||
| LSRHIGVTRL | DLKDIPNAIR | LVAPDLGILV | VSSVCLGICG | RLARNTRQSP | ||||
| HPRELDDDER | DVDASPTAGL | QEAATLAPTR | RSRLAARFRV | TAHWLLVAAG | ||||
| RVLAVTLLAL | AGIAHPSALS | SVYLLLFLAL | CTWWACHFPI | STRGFSRLCV | ||||
| AVGCFGAGHL | ICLYCYQMPL | AQALLPPAGI | WARVLGLKDF | VGPTNCSSPH | ||||
| ALVLNTGLDW | PVYASPGVLL | LLCYATASLR | KLRAYRPSGQ | RKEAAKGYEA | ||||
| RELELAELDQ | WPQERESDQH | VVPTAPDTEA | DNCIVHELTG | QSSVLRRPVR | ||||
| PKRAEPREAS | PLHSLGHLIM | DQSYVCALIA | MMVWSITYHS | WLTFVLLLWA | ||||
| CLIWTVRSRH | QLAMLCSPCI | LLYGMTLCCL | RYVWAMDLRP | ELPTTLGPVS | ||||
| LRQLGLEHTR | YPCLDLGAML | LYTLTFWLLL | RQFVKEKLLK | WAESPAALTE | ||||
| VTVADTEPTR | TQTLLQSLGE | LVKGVYAKYW | IYVCAGMFIV | VSFAGRLVVY | ||||
| KIVYMFLFLL | CLTLFQVYYS | LWRKLLKAFW | WLVVAYTMLV | LIAVYTFQFQ | ||||
| DFPAYWRNLT | GFTDEQLGDL | GLEQFSVSEL | FSSILVPGFF | LLACILQLHY | ||||
| FHRPFMQLTD | MEHVSLPGTR | LPRWAHRQDA | VSGTPLLREE | QQEHQQQQQE | ||||
| EEEEEEDSRD | EGLGVATPHQ | ATQVPEGAAK | WGLVAERLLE | LAAGFSDVLS | ||||
| RVQVFLRRLL | ELHVFKLVAL | YTVWVALKEV | SVMNLLLVVL | WAFALPYPRF | ||||
| RPMASCLSTV | WTCVIIVCKM | LYQLKVVNPQ | EYSSNCTEPF | PNSTNLLPTE | ||||
| ISQSLLYRGP | VDPANWFGVR | KGFPNLGYIQ | NHLQVLLLLV | FEAIVYRRQE | ||||
| HYRRQHQLAP | LPAQAVFASG | TRQQLDQDLL | GCLKYFINFF | FYKFGLEICF | ||||
| LMAVNVIGQR | MNFLVTLHGC | WLVAILTRRH | RQAIARLWPN | YCLFLALFLL | ||||
| YQYLLCLGMP | PALCIDYPWR | WSRAVPMNSA | LIKWLYLPDF | FRAPNSTNLI | ||||
| SDFLLLLCAS | QQWQVFSAER | TEEWQRMAGV | NTDRLEPLRG | EPNPVPNFIH | ||||
| CRSYLDMLKV | AVFRYLFWLV | LVVVFVTGAT | RISIFGLGYL | LACFYLLLFG | ||||
| TALLQRDTRA | RLVLWDCLIL | YNVTVIISKN | MLSLLACVFV | EQMQTGFCWV | ||||
| IQLFSLVCTV | KGYYDPKEMM | DRDQDCLLPV | EEAGIIWDSV | CFFFLLLQRR | ||||
| VFLSHYYLHV | RADLQATALL | ASRGFALYNA | ANLKSIDFHR | RIEEKSLAQL | ||||
| KRQMERIRAK | QEKHRQGRVD | RSRPQDTLGP | KDPGLEPGPD | SPGGSSPPRR | ||||
| QWWRPWLDHA | TVIHSGDYFL | FESDSEEEEE | AVPEDPRPSA | QSAFQLAYQA | ||||
| WVTNAQAVLR | RRQQEQEQAR | QEQAGQLPTG | GGPSQEVEPA | EGPEEAAAGR | ||||
| SHVVQRVLST | AQFLWMLGQA | LVDELTRWLQ | EFTRHHGTMS | DVLRAERYLL | ||||
| TQELLQGGEV | HRGVLDQLYT | SQAEATLPGP | TEAPNAPSTV | SSGLGAEEPL | ||||
| SSMTDDMGSP | LSTGYHTRSG | SEEAVTDPGE | REAGASLYQG | LMRTASELLL | ||||
| DRRLRIPELE | EAELFAEGQG | RALRLLRAVY | QCVAAHSELL | CYFIIILNHM | ||||
| VTASAGSLVL | PVLVFLWAML | SIPRPSKRFW | MTAIVFTEIA | VVVKYLFQFG | ||||
| FFPWNSHVVL | RRYENKPYFP | PRILGLEKTD | GYIKYDLVQL | MALFFHRSQL | ||||
| LCYGLWDHEE | DSPSKEHDKS | GEEEQGAEEG | PGVPAATTED | HIQVEARVGP | ||||
| TDGTPEPQVE | LRPRDTRRIS | LRFRRRKKEG | PARKGAAAIE | AEDREEEEGE | ||||
| EEKEAPTGRE | KRPSRSGGRV | RAAGRRLQGF | CLSLAQGTYR | PLRRFFHDIL | ||||
| HTKYRAATDV | YALMFLADVV | DFIIIIFGFW | AFGKHSAATD | ITSSLSDDQV | ||||
| PEAFLVMLLI | QFSTMVVDRA | LYLRKTVLGK | LAFQVALVLA | IHLWMFFILP | ||||
| AVTERMFNQN | VVAQLWYFVK | CIYFALSAYQ | IRCGYPTRIL | GNFLTKKYNH | ||||
| LNLFLFQGFR | LVPFLVELRA | VMDWVWTDTT | LSLSSWMCVE | DIYANIFIIK | ||||
| CSRETEKKYP | QPKGQKKKKI | VKYGMGGLII | LFLIAIIWFP | LLFMSLVRSV | ||||
| VGVVNQPIDV | TVTLKLGGYE | PLFTMSAQQP | SIIPFTAQAY | EELSRQFDPQ | ||||
| PLAMQFISQY | SPEDIVTAQI | EGSSGALWRI | SPPSRAQMKR | ELYNGTADIT | ||||
| LRFTWNFQRD | LAKGGTVEYA | NEKHMLALAP | NSTARRQLAS | LLEGTSDQSV | ||||
| VIPNLFPKYI | RAPNGPEANP | VKQLQPNEEA | DYLGVRIQLR | REQGAGATGF | ||||
| LEWWVIELQE | CRTDCNLLPM | VIFSDKVSPP | SLGFLAGYGI | MGLYVSIVLV | ||||
| IGKFVRGFFS | EISHSIMFEE | LPCVDRILKL | CQDIFLVRET | RELELEEELY | ||||
| AKLIFLYRSP | ETMIKWTREK | E |
Piezo1 має 2535 амінокислот, позаклітинний домен - CED та 26 ТМ. Канал складається з 3-х мономерів з загальною масою в 1.2 МДа. Форма каналу нагадує "пропеллер" з трьома лопостями. Йонну пору закриває CED-домен, що розташований з 2210 по 2457 а.к., між двома останніми трансмембранними доменами. Він відповідає за закриту та відкриту конформацію каналу. Основу каналу формують 3 типи ТМ доменів: peripheral helix (PH), outer helix,(OH), inner helix (IH). Іnner helix та outer helix формують йонну пору [9].
Ще однією специфічною частиною каналу є його "лопаті" - ділянки білку, що розташовані з ззовнішнього боку мембрани і виступають над поверхнею біліпідного шару[9].
На сьогодні більшість дослідників Piezo1 вважають, що механочутливість відбувається безпосередньо завдяки "лопатям", що змінюють свою конформацію у випадку зміни положення мембрани [10].
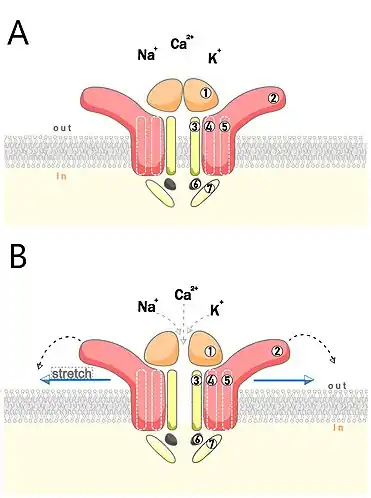
Взаємодія з фармакологічними агентами
До Piezo1 активується у відповідь на прикладання Yoda1, який має агоністичні властивості до людського та мишиного каналу Piezo1. EC50 (для мишиного) - 17 μМоль/л, (для людського)- 26.6 μМоль/л [11]. Відкривачі активатора дійшли висновку, що молекула стабілізує вікриту конформацію каналу, а не дестабілізує закриту.
Селективних блокаторів для каналу Piezo1 поки не відкрито. Робота каналу блокується рутенієвим червоним (Ruthenium red), йонами Гадолінію (Gd) [6], блокатором механочутливих йонних каналів - токсином GsMTx4 [12].
Експресія Piezo1 каналу в організмі
Білок-канал знайдено в наступних тканинах організму [8]
- Мозок;
- Оптичний нерв;
- Клітини пародонтальної зв'язки;
- Легені;
- Ендотелій судин;
- Еритроцити;
- Хондроцити (в суглобах);
- Гладенькі міоцити;
- Уротелій.
Роль Piezo1 під час ембріогенезу
Було показано в лабораторії професора David J Beech [13], що видалення Piezo1 призводить до порушення ембріогенезу аж до загибелі плоду не пізніше стадії Е.16.5. Лінії мишей Piezo-/- гинули через порушення формування судинної системи організму. Подальше дослідження показало, що ендотеліоцити в делетованих мишах розташовані хаотично і не формували організованих судин.
Розвиток нервової тканини також пов'язаний з Piezo1. Було показано, що на напрямок росту аксонів окрім концентрації NGF та ряду хемоатрактантів впливає щільність тканини, крізь яку він рухається. Блокування механочутливості в клітинах-попередниках нервових клітин сприяє зниженню темпів розвитку нервової системи [14].
Література
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Bae C., Gnanasambandam R., Nicolai C., Sachs F., Gottlieb P.A. (2013). Xerocytosis is caused by mutations that alter the kinetics of the mechanosensitive channel PIEZO1.. Proc. Natl. Acad. Sci. U.S.A. 110: E1162 — 1168. PubMed DOI:10.1073/pnas.1219777110
Посилання
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:28993 (англ.). Процитовано 22 серпня 2017.
- UniProt, Q92508 (англ.). Процитовано 22 серпня 2017.
- Coste, Bertrand; Xiao, Bailong; Santos, Jose S.; Syeda, Ruhma; Grandl, Jörg; Spencer, Kathryn S.; Kim, Sung Eun; Schmidt, Manuela та ін. (19 лютого 2012). Piezo proteins are pore-forming subunits of mechanically activated channels. Nature 483 (7388). с. 176–181. ISSN 0028-0836. doi:10.1038/nature10812. Процитовано 15 жовтня 2018.
- Coste, Bertrand; Mathur, Jayanti; Schmidt, Manuela; Earley, Taryn J.; Ranade, Sanjeev; Petrus, Matt J.; Dubin, Adrienne E.; Patapoutian, Ardem (1 жовтня 2010). Piezo1 and Piezo2 Are Essential Components of Distinct Mechanically Activated Cation Channels. Science (англ.) 330 (6000). с. 55–60. ISSN 0036-8075. PMC PMC3062430. PMID 20813920. doi:10.1126/science.1193270. Процитовано 15 жовтня 2018.
- Satoh, Kazuki; Hata, Mitsumi; Takahara, Seiji; Tsuzaki, Hidetoshi; Yokota, Hiroshi; Akatsu, Hiroyasu; Yamamoto, Takayuki; Kosaka, Kenji та ін. (2006-09). A novel membrane protein, encoded by the gene covering KIAA0233, is transcriptionally induced in senile plaque-associated astrocytes. Brain Research 1108 (1). с. 19–27. ISSN 0006-8993. doi:10.1016/j.brainres.2006.06.050. Процитовано 15 жовтня 2018.
- Wu, Jason; Lewis, Amanda H.; Grandl, Jörg (2017-01). Touch, Tension, and Transduction – The Function and Regulation of Piezo Ion Channels. Trends in Biochemical Sciences 42 (1). с. 57–71. ISSN 0968-0004. PMC PMC5407468. PMID 27743844. doi:10.1016/j.tibs.2016.09.004. Процитовано 15 жовтня 2018.
- Ge, Jingpeng; Li, Wanqiu; Zhao, Qiancheng; Li, Ningning; Chen, Maofei; Zhi, Peng; Li, Ruochong; Gao, Ning та ін. (21 вересня 2015). Architecture of the mammalian mechanosensitive Piezo1 channel. Nature 527 (7576). с. 64–69. ISSN 0028-0836. doi:10.1038/nature15247. Процитовано 15 жовтня 2018.
- Lewis, Amanda H; Grandl, Jörg (8 грудня 2015). Mechanical sensitivity of Piezo1 ion channels can be tuned by cellular membrane tension. eLife 4. ISSN 2050-084X. doi:10.7554/elife.12088. Процитовано 15 жовтня 2018.
- Syeda, Ruhma; Xu, Jie; Dubin, Adrienne E; Coste, Bertrand; Mathur, Jayanti; Huynh, Truc; Matzen, Jason; Lao, Jianmin та ін. (22 травня 2015). Chemical activation of the mechanotransduction channel Piezo1. eLife 4. ISSN 2050-084X. doi:10.7554/elife.07369. Процитовано 15 жовтня 2018.
- Bae, Chilman; Sachs, Frederick; Gottlieb, Philip A. (26 липня 2011). The Mechanosensitive Ion Channel Piezo1 Is Inhibited by the Peptide GsMTx4. Biochemistry 50 (29). с. 6295–6300. ISSN 0006-2960. doi:10.1021/bi200770q. Процитовано 15 жовтня 2018.
- Li, Jing; Hou, Bing; Tumova, Sarka; Muraki, Katsuhiko; Bruns, Alexander; Ludlow, Melanie J.; Sedo, Alicia; Hyman, Adam J. та ін. (10 серпня 2014). Piezo1 integration of vascular architecture with physiological force. Nature (En) 515 (7526). с. 279–282. ISSN 0028-0836. PMC PMC4230887. PMID 25119035. doi:10.1038/nature13701. Процитовано 15 жовтня 2018.
- Koser, David E; Thompson, Amelia J; Foster, Sarah K; Dwivedy, Asha; Pillai, Eva K; Sheridan, Graham K; Svoboda, Hanno; Viana, Matheus та ін. (19 вересня 2016). Mechanosensing is critical for axon growth in the developing brain. Nature Neuroscience 19 (12). с. 1592–1598. ISSN 1097-6256. doi:10.1038/nn.4394. Процитовано 15 жовтня 2018.