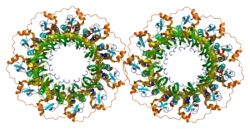RAD52
RAD52 (англ. RAD52 homolog, DNA repair protein) – білок, який кодується однойменним геном, розташованим у людей на короткому плечі 12-ї хромосоми.[4] Довжина поліпептидного ланцюга білка становить 418 амінокислот, а молекулярна маса — 46 169[5].
Послідовність амінокислот
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MSGTEEAILG | GRDSHPAAGG | GSVLCFGQCQ | YTAEEYQAIQ | KALRQRLGPE | ||||
| YISSRMAGGG | QKVCYIEGHR | VINLANEMFG | YNGWAHSITQ | QNVDFVDLNN | ||||
| GKFYVGVCAF | VRVQLKDGSY | HEDVGYGVSE | GLKSKALSLE | KARKEAVTDG | ||||
| LKRALRSFGN | ALGNCILDKD | YLRSLNKLPR | QLPLEVDLTK | AKRQDLEPSV | ||||
| EEARYNSCRP | NMALGHPQLQ | QVTSPSRPSH | AVIPADQDCS | SRSLSSSAVE | ||||
| SEATHQRKLR | QKQLQQQFRE | RMEKQQVRVS | TPSAEKSEAA | PPAPPVTHST | ||||
| PVTVSEPLLE | KDFLAGVTQE | LIKTLEDNSE | KWAVTPDAGD | GVVKPSSRAD | ||||
| PAQTSDTLAL | NNQMVTQNRT | PHSVCHQKPQ | AKSGSWDLQT | YSADQRTTGN | ||||
| WESHRKSQDM | KKRKYDPS |
Кодований геном білок за функцією належить до фосфопротеїнів. Задіяний у таких біологічних процесах, як пошкодження ДНК, репарація ДНК, рекомбінація ДНК, альтернативний сплайсинг. Білок має сайт для зв'язування з ДНК. Локалізований у ядрі.
Література
- Shen Z., Denison K., Lobb R., Gatewood J.M., Chen D.J. (1995). The human and mouse homologs of the yeast RAD52 gene: cDNA cloning, sequence analysis, assignment to human chromosome 12p12.2-p13, and mRNA expression in mouse tissues.. Genomics 25: 199 — 206. PubMed DOI:10.1016/0888-7543(95)80126-7
- Park M.S. (1995). Expression of human RAD52 confers resistance to ionizing radiation in mammalian cells.. J. Biol. Chem. 270: 15467 — 15470. PubMed DOI:10.1074/jbc.270.26.15467
- Kito K., Wada H., Yeh E.T., Kamitani T. (1999). Identification of novel isoforms of human RAD52.. Biochim. Biophys. Acta 1489: 303 — 314. PubMed DOI:10.1016/S0167-4781(99)00214-6
- Park M.S., Ludwig D.L., Stigger E., Lee S.H. (1996). Physical interaction between human RAD52 and RPA is required for homologous recombination in mammalian cells.. J. Biol. Chem. 271: 18996 — 19000. PubMed DOI:10.1074/jbc.271.31.18996
- Kitao H., Yuan Z.M. (2002). Regulation of ionizing radiation-induced Rad52 nuclear foci formation by c-Abl-mediated phosphorylation.. J. Biol. Chem. 277: 48944 — 48948. PubMed DOI:10.1074/jbc.M208151200
- Singleton M.R., Wentzell L.M., Liu Y., West S.C., Wigley D.B. (2002). Structure of the single-strand annealing domain of human RAD52 protein.. Proc. Natl. Acad. Sci. U.S.A. 99: 13492 — 13497. PubMed DOI:10.1073/pnas.212449899
Примітки
- Захворювання, генетично пов'язані з RAD52 переглянути/редагувати посилання на ВікіДаних.
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:9824 (англ.). Процитовано 11 вересня 2017.
- UniProt, P43351 (англ.). Процитовано 11 вересня 2017.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.