Іонообмінна хроматографія
Іо́нообмі́нна хроматогра́фія (англ. ion-exchange chromatography, IEC) — метод рідинної хроматографії, який базується на різній здатності розділюваних іонів до іонного обміну з нерухомою фазою (іонітом). В залежності від спорідненості до нерухомої фази розділювані іони рухаються із різною швидкістю: чим вища спорідненість, тим більша взаємодія частинок і менша швидкість.
Перші дані про застосування іонообмінної хроматографії датуються 1850 роком. Із введенням у 1970-х роках деяких модифікацій цей метод розвинувся до іонної хроматографії.
Іонообмінний механізм
Іонообмінна хроматографія розроблена для розділення різним чином заряджених чи поляризованих сполук між рухомою та нерухомою фазами. Рухома фаза зазвичає є водним буфером, в якому розчиняються вихідні речовини, а нерухома — органічною матрицею із хімічно закріпленими функціональними іонізованими групами, котрі містять протилежно заряджені замінні іони. До замінних іонів належать протони H+, гідроксильні групи OH-, однозаряджені іони металів, двозаряджені моноатомні іони (Ca2+, Mg2+), поліатомні неорганічні іони (SO42-, PO43-), а також органічні основи (NR2H+) і кислоти (RCOO-).
Розділення відбувається на основі зв'язування розділюваних іонів аналіту з протиіонами, що знаходяться на нерухомій фазі:
- ,
- де R — нерухома фаза;
- XCat, XAn — закріплені функціональні групи, що дисоціюють із утворенням іонів;
- М — розділюваний іон.
Для розділення суміші катіонів використовують відповідно катіоніти, а для суміші аніонів — аніоніти.
Нерухома фаза

В іонообмінній хроматографії колонки зазвичай наповнені кополімерами стирену і дивінілбензену, із ковалентно приєднаними функціональними групами. Як модифікація були запропоновані сферичні пористі частинки полімерів (розміром 30—40 мкм) або смоли, вкриті шаром пористого силікагелю.
В залежності від типів розділюваних іонів застосовують різні смоли:
| Тип | Функціональні групи | pH | Приклади |
|---|---|---|---|
| Сильнокислотні катіонообмінники | сульфонові кислоти | 4—13 | -SO3-, -CH2CH2SO3- |
| Слабкокислотні катіонообмінники | карбонові кислоти | 6—10 | -COO-, -CH2COO- |
| Сильнолужні аніонообмінники | четвертинні аміни | 2—12 | -CH2N(CH3)3+, -CH2CH2N(CH2CH3)3+ |
| Слабколужні аніонообмінники | аміни | 2—9 | -NH3+, -CH2CH2NH(CH2CH3)2+ |
Спорідненість аніонів до сильнолужних аніонітів зменшується зі зменшенням їхньої поляризованості:
- SO42– > I– > HSO4– > NO3– > Br– > NO2– > Cl– > HCO3– > CH3COO– > OH– > F–
Спорідненість катіонів до типових сильнокислотних катіонообмінних смол знижується зі збільшенням радіусу їхніх гідратів та зменшенням заряду:
- Ce4+ > Al3+ > Ba2+ > Pb2+ > Ca2+ > Ni2+ > Cd2+ > Cu2+ > Co2+ > Zn2+ > Mg2+ > Ag+ > K+ > NH4+ > Na+ > H+ > Li+
У випадку розділювання металів, що близькі за своїми властивостями (наприклад, лантаноїдів), застосовують комплексоутворювачі (наприклад, ЕДТА, лимонну кислоту). В цьому випадку взаємодія комплексу з іонітом визначатиметься ступенем зв'язування металу з лігандами і загальним зарядом комплексу.
Рухома фаза
Рухомою фазою в іонообмінній хроматографії зазвичай є водний буфер, іонний склад та pH якого підбирають, виходячи з бажаного часу утримування. Для розділюваних катіонів рухома фаза (елюент) — це розчини кислот, для аніонів — розчини лугів.
У деяких випадках, зокрема, для іонів з високою спорідненістю, застосовується елюент, іонна сила (або pH) якого збільшується у часі. Це дозволяє досягнути ефективнішого заміщення іонів, що взаємодіють з іонообмінними смолами.
Детектування і модифікації методу
Найпоширенішим детектором іонів на виході з колонки є кондуктометричний, що реєструє електропровідність розчину при проходженні повз нього іонів. Однак при високій іонній силі елюенту детектор втрачає свою чутливість.
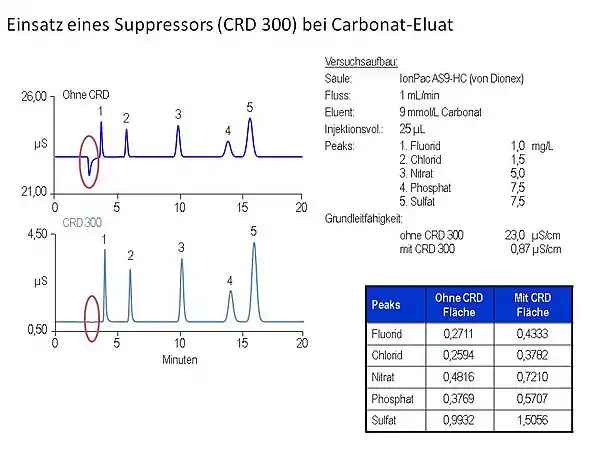
Використання пригнічувальної колонки
Сигнали при виході: флуоридів (1), хлоридів (2), нітратів (3), фосфатів (4), сульфатів (5) в залежності від часу утримування (хв)
Модифікацією методу детекції стало розміщення між колонкою та детектором другої, пригнічувальної колонки (супресора), яка селективно видаляє з розчину іони елюенту, залишаючи розділювані іони. Наприклад, при використанні як елюенту хлоридної кислоти, в розчині знаходитимуться іони H+ та Cl-, які видаляються смолою із закріпленими гідроксильними групами:
Або для елюенту гідрокарбонату натрію:
Недоліком пригнічувальної колонки є те, що після певного часу роботи ємність знижується і її необхідно замінювати. В сучасних приладах використовуються мембранні пригнічувачі, котрі регенеруються безпосередньо під час роботи.
Одноколонкова іонна хроматографія
У випадку, якщо електропровідність рухомої фази є малою, достатнім для детекції є використання лише однієї колонки. У цьому випадку застосовують іонообмінники малої ємності. До елюентів з малою електропровідністю належать розчини слабких органічних кислот: фталевої, бензойної, саліцилової тощо.
Такий метод застосовується при визначенні іоногенних речовин, наприклад, амінокислот. Проте його чутливість є нижчою, ніж у двоколонковому варіанті.
Фотометричне детектування
Необхідність застосування двоколонкового методу також відсутня при визначенні сполук, що поглинають видиме чи ультрафіолетове випромінювання (такими зазвичай є органічні сполуки). Для цього застосовують відповідні фотометри. Також можливе зворотнє застосування фотометру: детектування сполук, які не поглинають випромінювання, із рухомою фазою, що поглинає. В такому випадку при проходженні повз детектор досліджувані іони будуть знижувати поглинання розчину, що вимірюватиметься детектором.
Застосування
Іонообмінна хроматографія широко використовується для розділювання фенолів та карбонових кислот, а також біологічних сполук: аміноцукрів, нуклеотидів, нуклеозидів, пуринових і піримідинових основ тощо.
Джерела
- Lunn, G. Chromatography // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 6. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Acikara, Özlem B. Ion-Exchange Chromatography and Its Applications // Column Chromatography / Dean F. Martin, Barbara B. Martin, editor. — InTech, 2013. — 218 p. — ISBN 978-953-51-1074-3. — DOI: (англ.)
- Harvey, D. Modern analytical chemistry. — The McGraw-Hill, 2000. — P. 590—593. — ISBN 0-07-116953-9. (англ.)
- Отто М. Современные методы аналитической химии / Пер. с нем. под ред. А. В. Гармаша. — М. : Техносфера, 2004. — Т. 2. — С. 70—74. — ISBN 5-94836-017-2. (рос.)
- Химический энциклопедический словарь / Под ред. И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)