Бензойна кислота
Бензо́йна кислота́ — органічна сполука, найпростіша ароматична одноосновна карбонова кислота складу С6Н5СООН. За звичайних умов кислота є безбарвними кристалами, добре розчинними в етерах, спиртах, хлороформі, мало розчинними у воді. Кислота утворює ряд солей — бензоатів.
| Бензойна кислота | |
|---|---|
 | |
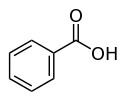 Скелетна структурна формула |
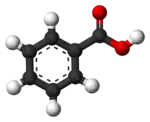 Кулестрижнева модель |
| Інші назви | бензенкарбонова кислота |
| Ідентифікатори | |
| Номер CAS | 65-85-0 |
| PubChem | 243 |
| Номер EINECS | 200-618-2 |
| DrugBank | 03793 |
| KEGG | D00038 і C00180 |
| Назва MeSH | D02.241.223.100.120 і D02.455.426.559.389.127.117 |
| ChEBI | 30746 |
| RTECS | DG0875000 |
| SMILES |
c1ccc(cc1)C(=O)O |
| InChI |
InChI=1S/C7H6O2/c8-7(9)6-4-2-1-3-5-6/h1-5H,(H,8,9) |
| Номер Бельштейна | 636131 |
| Номер Гмеліна | 2946 |
| 3DMet | B00053 |
| Властивості | |
| Молекулярна формула | C6H5COOH |
| Молярна маса | 122,122 г/моль |
| Зовнішній вигляд | безбарвні кристали |
| Густина | 1,2659 г/см³ (15 °C) |
| Тпл | 122,35 °C[1] |
| Ткип | 249,2 °C[1] |
| Розчинність (вода) | 0,17 г/100 г (0 °C) 0.29 г/100 г (20 °C) 0.60 г/100 г (40 °C) 1.20 г/100 г (60 °C) 2.75 г/100 г (80 °C) 6.85 г/100 г (95 °C) |
| Кислотність (pKa) | 4,204[2] |
| Показник заломлення (nD) | 1,504 (132 °C) |
| В'язкість | 1,26 мПа·с (130 °C) |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-385,2 кДж/моль[2] |
| Ст. ентропія S |
167,6 Дж/(моль·K)[2] |
| Теплоємність, c |
146,8 Дж/моль·K)[2] |
| Небезпеки | |
| ЛД50 | 2530 мг/кг (пацюки, орально) |
| Температура спалаху | 121,1 °C |
| Температура самозаймання | 573 °C |
| Пов'язані речовини | |
| Інші катіони | бензоат натрію, бензоат калію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Термін бензойна кислота сполуки походить від назви бензойної смоли, яку виділяли з дерев стиракс у Південно-Східній Азії. Вперше кислота була виділена в чистому вигляді і описана французьким алхіміком Блезом де Віженером у 16 столітті — шляхом дистиляції бензоїну. У 1832 році Фрідріх Велер та Юстус фон Лібіх синтезували бензойну кислоту з бензальдегіду і встановили її формулу.
Бензойна кислота та її похідні широко розповсюджені у природі. Так, смола бензоїн містить 12—18% бензойної кислоти, а також значну кількість її естерів. Також ці сполуки містяться у корі, листях, плодах вишні і чорносливу.
Фізичні властивості
Бензойна кислота є прозорими, голкоподібними кристалами. Має температуру кипіння 249,2 °C, але кристали можуть сублімуватися вже при 100 °C.
Кислота слабко розчиняється у воді, і добре — в органічних розчинниках.
| Ацетон | 55,60 |
| Бензен | 12,17 |
| Тетрахлорометан | 4,14 |
| Етанол | 58,40 |
| Гексан | 0,94 (при 17 °C) |
| Метанол | 71,50 (при 23 °C) |
| Толуен | 10,60 |
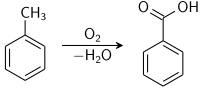
Отримання
Промисловий метод
Майже вся отримувана у промислових масштабах бензойна кислота синтезується шляхом каталітичного окиснення толуену:
Її розробили на німецькому підприємстві IG Farbenindustrie у роки Другої світової війни. Реакцію проводять за таких умов:
- тиск у реакторі — 200—700 кПа (~2—7 атм)
- температура в реакторі — 136—160 °C
- концентрація каталізатору — 25—1000 мг/кг
- концентрація продукту — 10—60%
До вихідної сировини пред'являються вимоги високої чистоти — домішки сульфуру, нітрогену, фенолів та олефінів можуть сповільнювати хід окиснення. Каталізатором найчастіше є солі кобальту: нафтенат, ацетат, октоат. Як співкаталізатор також застосовуються добавки марганцю, однак в такому випадку рівновага реакції буде порушена і стане значним утворення побічного продукту — бензальдегіду. Використання бромідів (наприклад, броміду кобальту) дозволяє суттєво збільшити ефективність окисних процесів у системі, але такі добавки спричинюють високу корозійну дію і вимагають встановлення дорогого обладнання з титану.
Ступінь перетворення толуену складає 50%, з яких 80% є бензойною кислотою.
Щорічний обсяг виробництва бензойної кислоти складає 750 тис. тон.[3]
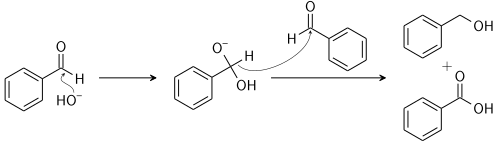
Лабораторні методи
При обробці бензальдегіду водно-спиртовим розчином лугу (наприклад, 50% KOH), він диспропорціонує із утворенням бензойної кислоти і бензилового спирту:
Бензойну кислоту можна отримати карбоксилюванням магній- або літійорганічних сполук, наприклад, фенілвмісного реактиву Гріньяра C6H5MgBr (в етері):
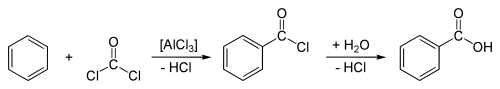
Кислота утворюється при гідролізі бензоїлхлориду:
Іншим методом є синтез кислоти із бензену — шляхом ацилювання його фосгеном у присутності хлориду алюмінію (реакція Фріделя — Крафтса):
Хімічні властивості
Бензойна кислота проявляє усі властивості карбонових кислот: утворення естерів при взаємодії зі спиртами, утворення амідів тощо.
Бензойна кислота є стійкою до дії багатьох окисників: повітря, перманганатів, гіпохлоритів. Однак, при нагріванні понад 220 °C вона взаємодіє із солями міді(II), утворюючи фенол і його похідні. В результаті взаємодії кислоти з аміаком утворюється анілін.
При нагріванні бензойної кислоти до 370 °C у присутності каталізатора (мідний або кадмієвий порошки), відбувається декарбоксилювання, що веде до бензену на незначних кількостей фенолу.
За участі каталізатору оксиду цирконію бензойну кислота може гідруватися до бензальдегіду із кількісним виходом. А гідрування в присутності благородних металів веде до утворення циклогексанкарбонової кислоти (гексагідробензойної).
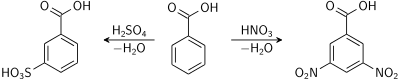
Хлорування сполуки дає продуктом переважно 3-хлоробензойну кислоту. Нітрування і сульфування відбувається аналогічно за третім положенням.
Токсичність
Бензойна кислота є речовиною середньої токсичності. Щоденні дози кислоти до 5—10 мг/кг не мають впливу на здоров'я.
Речовина може подразнювати слизові оболонки людини, тому під час роботи із кислотою необхідно користуватися захистом органів дихання.
Застосування
Основна частина отримуваної бензойної кислоти застосовується у виробництві капролактаму і віскози; деякі підприємства, що синтезують дані речовни мають власні потужності для отримання бензойної кислоти. Також значним є використання кислоти у виробництві її солей — бензоатів: бензоату калію, натрію, кальцію тощо. Ці сполуки знайшли широке застосування як харчові й косметичні консерванти, інгібітори корозії.
Із 1909 року бензойну кислоту дозволено використовувати у продуктах харчування, де вона виконує функції консерванту, у концентрації не більше 0,1%. В реєстрі харчових додатків Європейського Союзу бензойна кислота має код E210.
Бензойна кислота є сировиною для виробництва барвників, наприклад, анілінового синього та деяких антрахінонових барвників.
Також незначним є застосування бензойної кислоти у медицині: кислота використовується у виготовленні протимікробних і фунгіцидних препаратів.[4]
Примітки
- За тиску 101,3 кПа.
- Lange's Handbook of Chemistry / John A. Dean. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Myers Richard L. The 100 Most Important Chemical Compounds. — Westport, CT : Greenwood Press, 2007. — 326 p. — ISBN 978-0-313-33758-1. (англ.)
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.?)
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Opgrande J. L., Brown E. E., Hesser M., Andrews J. Benzoic Acid // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 4. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Myers Richard L. The 100 Most Important Chemical Compounds. — Westport, CT : Greenwood Press, 2007. — 326 p. — ISBN 978-0-313-33758-1. (англ.)
- Maki T., Takeda K. Benzoic Acid and Derivatives // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 1-5. — DOI: (англ.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.
- Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985.