Гідрокарбонат натрію
Бікарбона́т на́трію або на́трій гідрокарбона́тний — хімічна сполука з формулою NaHCO3, біла тверда речовина з легким солонувато-лужним смаком, який нагадує смак пральної соди (карбонат натрію). Природна форма — мінерал нахколіт. Поширена назва "бікарбонат натрію" завдячує назві бікарбонат іону (HCO3—), широко залученого у біохімічних процесах організму. Є одним із мінеральних компонентів природних джерел води. Він знаходиться в розчиненому вигляді в жовчі, де служить для нейтралізації кислотності соляної кислоти, яка виробляється в шлунку і виводиться у дванадцятипалу кишку тонкої кишки. Ця речовина відома з давніх-давен, широко використовувалась у миловарінні. У розмовній мові її називають питна сода. Латинська (медична) назва — Natrium carbonicum monobasicum, або Natrii hydrocarbonas.
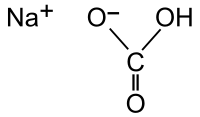
| Гідрокарбонат натрію | |
|---|---|
 | |
 | |
| Ідентифікатори | |
| Номер CAS | 144-55-8 |
| Номер EINECS | 205-633-8 |
| DrugBank | 01390 |
| KEGG | C12603 і D01203 |
| ChEBI | 32139 |
| RTECS | VZ0950000 |
| Код ATC | B05XA02 і B05CB04 |
| SMILES |
C(=O)(O)[O-].[Na+][1] |
| InChI |
InChI=1S/CH2O3.Na/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
| Номер Бельштейна | 4153970 |
| Властивості | |
| Молекулярна формула | NaHCO3 |
| Молярна маса | 84,01 г/моль |
| Зовнішній вигляд | білі кристали |
| Густина | 2,20 г/см³ |
| Тпл | 50 °C |
| Ткип | 851 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
Стародавні єгиптяни використовували природні родовища соди, суміш, що складається переважно з карбонату натрію, бікарбонату декагідрату та натрію. Сода використовувалась як засіб для чищення, як мило. Широко використовується з 1800-х років у комерційному рибальстві, щоб запобігти псуванню свіжоспійманої риби.
Виробництво
NaHCO3 в основному виробляється реакцією хлориду натрію, аміаку та вуглекислого газу у воді. Карбонат кальцію використовується як джерело CO2 і, як наслідок, оксиду кальцію. Використовується для відновлення аміаку з хлористого амонію. Виробництво близько 100 000 тонн/рік (станом на 2001 р.).
NaHCO3 може бути отриманий у результаті реакції вуглекислого газу з водним розчином із гідроксидом натрію. Первинна реакція утворює карбонат натрію:
- СО2 + 2NaOH → Na2CO3 + H2O
Подальше додавання двоокису вуглецю утворює бікарбонат натрію, який при досить високій концентрації осідає:
- Na2CO3 + СО2 + H2O → 2NaHCO3
Видобуток
Природні родовища нахколіну (NaHCO3) знайдені в пластах еоцену (55,8—33,9 млн років) у Колорадо. Нахколін наносився як осад в періоди високого випаровування у водоймі. Сода комерційно видобувається, розчиненням нахколіну в гарячій воді й відновлюється природним процесом кристалізації при охолодженні.
Хімічні властивості
Бікарбонат натрію — амфотерна сполука. Водні розчини мають слаболужні властивості у зв'язку з утворенням вуглекислоти та гідроксид-іона.
Реакція бікарбонату натрію й кислоти утворює солі й вуглекислоту, яка легко розкладається на вуглекислий газ і воду:
- NaHCO3 + HCl → NaCl + H2CO3
- H2CO3 → H2O + CO2
Бікарбонат натрію вступає в реакцію з оцтовою кислотою, з утворенням ацетату натрію, води й вуглекислого газу:
- NaHCO3 + СН3COOH → CH3COONa + H2O + CO2
Бікарбонат натрію вступає в реакцію з основами, такими як гідроксид натрію з утворенням карбонатів:
- NaHCO3 + NaOH → Na2CO3 + H2O
Бікарбонат натрію вступає в реакцію з карбоксильною групою білків, з утворенням СО2. Ця реакція використовується для перевірки наявності карбоксильних груп.
Термічний розклад
Вище 70 °C, бікарбонат натрію поступово розпадається на карбонат натрію, воду і вуглекислий газ. Розкладання при температурі 200 °C:
- 2NaHCO3 → Na2CO3 + H2O + CO2
Більшість бікарбонатів вступає в реакцію дегідратації. При подальшому нагріванні перетворюється в оксид натрію (при температурі близько 1000 °C.):
- Na2CO3 → Na2O + CO2
Ці перетворення використовуються при використанні NaHCO3 в пожежогасінні («BC порошок») як порошкоподібний вогнегасник.
Застосування
Кухня
Бікарбонат натрію наряду з карбонатом амонію переважно використовуються в кулінарії для випікання як розпушувача, вступаючи в реакцію з кислими компонентами рідкого тіста, випускає вуглекислий газ, який викликає розширення тіста й формує характерні текстури в млинцях, пирогах, хлібі та інші хлібобулочних виробах. Багато видів випічки містять бікарбонат натрію у поєднанні з одним або декількома кислими фосфатами (які особливо добре вступають в реакцію).
Бікарбонат натрію іноді використовується в приготуванні овочів, щоб розм'якшити їх, хоча це вийшло з моди, оскільки більшість людей тепер надають перевагу свіжим овочам, бо вони містять більше поживних речовин. Утім, все ще використовується в азійській кухні, щоб розм'якшити м'ясо. Бікарбонат натрію може реагувати з кислотами в харчових продуктах, у тому числі з вітаміном С (L-аскорбінова кислота).
Термічне розкладання бікарбонату натрію діє як розпушувач, випускаючи вуглекислий газ при високих температурах. Утворення вуглекислого газу починається при температурі вище 80 °C.
Нейтралізація кислот і основ
Багато лабораторій тримають бікарбонат натрію під рукою, оскільки він проявляє амфотерні властивості, реагуючи з кислотами й основами. Крім того, він відносно нешкідливий у великій кількості, отже, немає нічого поганого у використанні надлишку бікарбонату натрію. Широкий спектр його використання спричинений його нейтралізувальними властивостями, зокрема для скорочення поширення білого фосфору із запальних куль всередині рани, для підвищення pH води (збільшення загальної лужності), де містяться високі концентрації хлору (2—5 проміле) в плавальних басейнах і акваріумах.
Медичне застосування
Як лікувальний засіб соду застосовують:
- для пом'якшення кашлю: сода сприяє розрідженню мокротиння;
- у вигляді полоскань при болі в горлі як бактерицидний і протизапальний засіб;
- при раптовому нападі аритмії (слабкий розчин соди допоможе заспокоїти серцебиття);
- при гіпертонії (виводить рідину з організму, тим самим допомагаючи знизити артеріальний тиск);
- для поповнення втраченої рідини організмом: при проносах, блювоті;
- для зняття свербіння при укусах комах;
- при застуді (інгаляції содовим розчином);
- при кон'юнктивітах (промивають очі слабким розчином соди);
- при лікуванні грибкових захворювань ніг (примочки зі слабкого розчину соди);
- для очищення та відбілювання зубів;
- для розм'якшення ороговілої шкіри на ліктях і ступнях ніг (теплі ванночки з содою);
- при печії (як препарат, активно нейтралізує соляну кислоту в шлунку).
Бікарбонат натрію може бути використаний у першій медичній допомозі, при лікуванні опіків, для запобігання утворення міхурів і рубців. Це пов'язано з ендотермічною реакцією, яка відбувається між бікарбонатом натрію і водою. Натрій бікарбонат має антисептичні властивості. Він використовується також для лікування гіперкаліємії. Оскільки бікарбонат натрію може призвести до алкалозу, його іноді використовують для лікування передозування аспірину. Аспірину потрібно кисле середовище для належного поглинання і лужне середовище запобігає поглинанню у випадку передозування. Бікарбонат натрію також використовується в лікуванні передозування антидепресантами. Він може також застосовуватися місцево у вигляді пасти, щоб зменшити укуси комах.
Перш ніж використовувати соду в лікувальних цілях, необхідно обов'язково проконсультуватися з лікарем, оскільки ви можете нашкодити своєму здоров'ю.
Особиста гігієна
Бікарбонат натрію може бути використаний як ексфоліант. Його частинки округлої і тонкої текстури ідеально підходять для пілінгу. Сода як відлущуючий скраб видаляє безбарвні клітини шкіри, які постраждали від гіперпігментації і рубців.
Бікарбонат натрію також використовується як інгредієнт у рідинах для полоскання рота. Він працює як механічний очищувач для зубів і ясен, нейтралізує виробництво кислоти в роті, а також як антисептик, щоб запобігти зараженню інфекціями.
Паста, вироблена з бікарбонату натрію і 3 % перекису водню, може бути використана як альтернатива пастам без фтору. Паста з бікарбонатом натрію в поєднанні з іншими інгредієнтами може бути використана як сухий або вологий дезодорант. Сода може бути використана і як шампунь.
Харчова сода в спорті
Невеликі кількості бікарбонату натрію корисні як добавка для спортсменів у швидкісно-подій на основі, як і середні дистанції бігу, тривалістю від однієї до семи хвилин. Але передозування становить серйозну небезпеку, оскільки бікарбонат натрію слаботоксичний. Крім того, така практика призводить до значного збільшення натрію у раціоні.
Як очищувальний засіб
Паста з соди може бути дуже ефективною в прибиранні та очищені. Для очищення алюмінієвих об'єктів використання бікарбонату натрію не рекомендується, оскільки він знищує тонкий захисний інертний шар оксиду і робить цей метал дуже реактивним. Розведення в теплій воді може видалити плями зі срібла.
Соду зазвичай додають при пранні як пом'якшувач, а також для видалення запахів з одягу. Бікарбонат натрію також ефективний у видаленні плям від чаю та кави на чашках при розведенні з теплою водою.
Як біопестицид
Бікарбонат натрію може бути ефективним способом контролю росту грибка, і в Сполучених Штатах зареєстрований як біопестицид.
Різне
Бікарбонат натрію може бути використаний для гасіння невеликих пожеж, які були викликанні загорянням жиру або загорянням електрики. Тим не менше, він не може бути використаний при пожежах глибоких фритюрниць, це може привести до розбризкування масла.
Його можна вводити в басейни, спа і садові ставки для підняття рН рівня. Він слабкий дезінфікуючий засіб, і може бути ефективним фунгіцидом проти деяких організмів.
Оскільки він діє як нейтралізуючий агент, то він може бути використаний для поглинання запахів, викликаних сильними кислотами. Ця його властивість використовується для поглинання запаху в старих книгах.
Виробництво в Україні
Єдиним виробником харчової соди в Україні до 2010 року був Лисичанський содовий завод. У цьому ж році виробництво заводі зупинилось у зв'язку з банкрутством. Починаючи з 2013 року основним виробником харчової соди в країні став Кримський содовий завод. Після 2014 року Кримський содовий завод опинився на території, окупованій Росією.
ПАТ «Кримський содовий завод» займав близько 80 % українського ринку кальцинованої соди і понад 2 % світового. У 2013 році завод випустив 582 тис. тонн соди кальцинованої, у тому числі сода марки «А» — 427,5 тис. тонн, 24,4 тис. тонн харчової солі, а також понад 4 тис. тонн харчової соди. З 2004 року «Кримський содовий завод» входить до міжнародної групи компаній Group DF.
Примітки
- SODIUM BICARBONATE
Джерела
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
