Бензоїлхлорид
Бензоїлхлорид ― органічна сполука, належить до класу хлорангідридів карбонових кислот. За стандартних умов є безбарвною рідиною з проникливим, різким і неприємним запахом, змішується з бензеном.[2] Лакриматор.[1]
| Структурна формула | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Загальна інформація | |||||||||||||||||||
| Преференційна назва ІЮПАК | Бензоїл хлорид | ||||||||||||||||||
| Систематична назва ІЮПАК | Бензоїл хлорид | ||||||||||||||||||
| Інші назви |
Бензен карбонілхлорид α-хлоробензальдегід | ||||||||||||||||||
| Хімічна формула | С7H5ClO | ||||||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | ||||||||||||||||||
| Зовнішні ідентифікатори / Бази даних | |||||||||||||||||||
| |||||||||||||||||||
| Властивості | |||||||||||||||||||
| Молярна маса | 140,57 г/моль | ||||||||||||||||||
| Агрегатний стан |
рідина | ||||||||||||||||||
| Густина |
1,22 г/см3 (20 °C) [1] | ||||||||||||||||||
| Температура плавлення |
-1 °C [1] | ||||||||||||||||||
| Температура кипіння |
197 °C [1] | ||||||||||||||||||
| Температура самозаймання |
600 °C [1] | ||||||||||||||||||
| Безпека | |||||||||||||||||||
| Маркування згідно системі УГС
Небезпека | |||||||||||||||||||
| H-фрази | H: H302+H312, H331, H314, H317 | ||||||||||||||||||
| P-фрази | P: P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310 | ||||||||||||||||||
| EUH-фрази | EUH: Заходи безпеки відсутні | ||||||||||||||||||
| LD50 |
1900 мг/кг (щур, орально) [1] | ||||||||||||||||||
| LC50 |
34,7 мг/л (96 годин, риби) [1] | ||||||||||||||||||
| Вибухонебезпечність | |||||||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | |||||||||||||||||||
Отримання
Старий спосіб отримвння бензоїлхлориду ― хлорування бензальдегіду:[3]
Пізніше було винайдено новий метод, який полягає у хлоруванні бензилового спирту[3]:
Зараз у промисловості бензоїлхлорид отримують неповним гідролізом трихлоротолуену, який отримують хлорувнням толуену.[2]
Замість води може бути застована бензойна кислота:[2]
Окрім цього, можливе хлорування бензойної кислоти фосгеном, тіонілхлоридом і пентахлоридом фосфору:[2]
Хімічні властивості
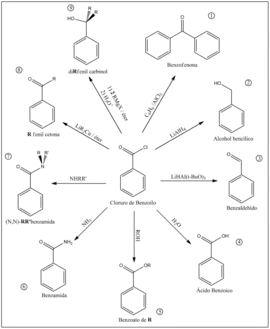
Реагує з речовинами, що містять активний атом гідрогену, бензоїлюючи їх. Наприклад, бурхливо реагує з водою, утворюючи бензойну кислоту. При малих кількостях води утворюється ангідрид бензойної кислоти:[2]
Іншим важливим прикладом бензоїлювання є реакція з гідроген пероксидом у лужному середовищі, внаслідок якої утворюється бензоїлпероксид:[4]
Джерела
- GESTIS Substance Database. gestis-database.dguv.de. Процитовано 8 грудня 2021.
- Maki, Takao; Takeda, Kazuo (15 червня 2000). У Wiley-VCH Verlag GmbH & Co. KGaA. Benzoic Acid and Derivatives. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a03_555. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a03_555.
- , Wilmot, Henderson Bruce & Percival John Garnett, "Manufacture and production of benzoyl chloride"
- El-Samragy, Yehia (2004). Chemical and Technical Assessment (PDF). Benzoyl Peroxide. 61st JECFA (Joint FAO/WHO Expert Committee on Food Additives): 1. Процитовано 31 жовтня 2013.