Бензоїлпероксид
Бензої́лперокси́д, пере́кис бензої́лу (англ. Benzoyl peroxide) — сполука ряду органічних пероксидів. За звичайних умов є безбарвними ромбічними або пірамідальними кристалами.
| Бензоїлпероксид | |
|---|---|
 | |
 | |
| Інші назви | перекис бензоїлу |
| Ідентифікатори | |
| Номер CAS | 94-36-0 |
| Номер EINECS | 202-327-6 |
| DrugBank | 09096 |
| KEGG | D03093 і C19346 |
| ChEBI | 82405 |
| RTECS | DM8575000 |
| Код ATC | D10AE01 |
| SMILES |
C1=CC=C(C=C1)C(=O)OOC(=O)C2=CC=CC=C2[1] |
| InChI |
InChI=1S/C14H10O4/c15-13(11-7-3-1-4-8-11)17-18-14(16)12-9-5-2-6-10-12/h1-10H |
| Властивості | |
| Молекулярна формула | C10H14O4 |
| Молярна маса | 242,227 г/моль |
| Тпл | 105 °C[2] |
| Розчинність (вода) | 1,6·10-4 % (20 °C) |
| Показник заломлення (nD) | 1,543 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-369,4 кДж/моль (тв.) |
| Небезпеки | |
| ГДК (Україна) | 5 мг/м³ |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Контакт із речовиною може спричинювати опіки шкіри та слизових оболонок.
Фізичні властивості
Бензоїлпероксид є важкорозчинним у воді, натомість він помірно розчиняється в органічних розчинниках:
| Розчинник | Розчинність, г у 100 г |
|---|---|
| етанол | 1,2 |
| ацетон | 18,5 |
| хлороформ | 26,8 |
| хлоробензен | 16,7 |
| етилацетат | 14,4 |
| бензен | 18,6 |
| діетиловий етер | 8,6 |
| діоксан | 25,2 |
У твердому вигляді та у розчинах бензоїлпероксид є вибухонебезпечним. Теплота згоряння — 6465,4 кал/г.
Отримання
Для технічних цілей бензоїлпероксид синтезують реакцією бензоїлхлориду із пероксидом водню в лужному середовищі:
Побічним продуктом реакції є бензойна кислота.
При необхідності отримання чистого пероксиду його осаджують метанолом з розчину хлороформу за кімнатної температури.
Хімічні властивості
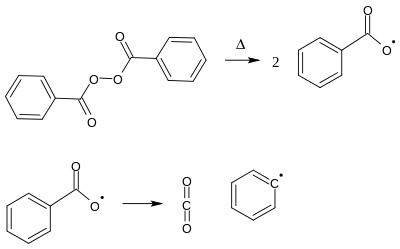
Основною реакцією, що визначає практичне застосування бензоїлпероксиду, є утворення бензоїл-радикалів, які із часом розпадаються до феніл-радикалів:
Так, у розчині бензену половина бензоїлпероксиду розкладається за 15 годин при 70 °C, за 2,2 год при 85 °C і за 0,4 год при 100 °C.
При гідролізі сполуки утворюються бензойна і пербензойна кислоти:
Як типовий пероксид, бензоїлпероксид є доволі сильним окисником. Він окиснює фосфіни R3P до R3PO, сульфіди — до сульфоксидів, з олефінами за його участі протікає реакція епоксидування.
Бензенове ядро у сполуці нітрується у мета-положення, утворюючи м-нітробензоїлпероксид.
Застосування
Найширше бензоїлпероксид використовується як джерело радикалів для ініціювання реакцій радикальної полімеризації (наприклад, у виробництві полістиролу, поліхлорвінілу), джерело фенільних радикалів в органічному синтезі. Також він є отверджувачем поліефірних смол, вулканізатором, відбілювачем жирів та олій.
У медицині використовується як засіб для боротьби з акне та для відлущення шкіри.
Примітки
- BENZOYL PEROXIDE
- За тиску 101,3 кПа.
Джерела
- Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М. : Советская энциклопедия, 1988. — Т. 1. АБЛ—ДАР. — 623 с. (рос.)
- Химический энциклопедический словарь / Под ред. И. Л. Кнунянца. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)