ГАМКA-рецептор
ГАМКA-рецептор — група клітинних рецепторів, ліганд-залежних хлорних іонних каналів, відчинення пори яких керуються молекулами гамма-аміномасляної кислоти, основного гальмівного нейромедіатора в мозку ссавців, зокрема людини. Це один з 3 підтипів ГАМК-рецепторів та одна з груп надродини рецепторів з цистеїновою петлею. Кожен ГАМКA-рецептор утворюється п'ятьма білковими субодиницями, які кодуються окремими генами. Ці рецептори розташовані переважно в синапсах між нейронами головного мозку. Відкриття іонного каналу ГАМКA-рецептора призводить до входу іонів хлору до зрілого нейрона, зниження значення його мембранного потенціалу (гіперполяризації) та гальмування електричної активності. Мутації в генах, що кодують субодиниці ГАМКA-рецепторів призводять до низки захворювань, зокрема деяких видів епілепсії. Ці рецептори є мішенями деяких фармацевтичних препаратів, як наприклад барбітурати та бензодіазепіни.[1][2][3]
Структура
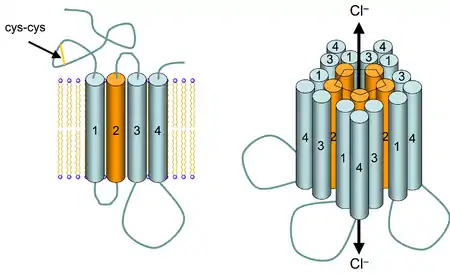
Іонотропні ГАМКA-рецептори вперше були виділені з мозку бика в 1987 році, і їхня структура була тоді визначена як така, що складається з двох субодиниць. Але пізніше завдяки методикам молекулярного клонування було виділено велику кількість різних субодиниць, що можуть входити до складу цього рецептора. Перелік субодиниць включає сім різних родин, багато з яких налічують більш ніж один ген. Це родини α (6 ізоформ), β (три ізоформи), γ (три ізоформи), а також δ, ε, π та θ (одна ізоформа в кожній). Гомологія (збіжність) в послідовностях амінокислот між ізоформами однієї родини досягає щонайменше 70 %, в той час як між представниками різних родин — менше ніж 40 %; докладніше про властивості рецепторів, що утворюються різними комбінаціями субодиниць, див. у таблиці 1.[4]
Кожний функціональний ГАМКA-рецептор являє собою гетеропентамер, де всі п'ять субодиниць мають однакову третинну структуру. Ця структура полягає в наявності великого N-кінцевого домену, характерною ознакою котрого для цього типу рецепторів є дисульфідний місток між двома залишками цистеїну (так звана «cys-cys-петля») — риса, притаманна всім іонно-канальним рецепторам. Також на N-кінцевому домені знаходяться численні місця зв'язування різноманітних лігандів та ділянка, що активує рецептор при зв'язуванні з ним молекул ГАМК[5].
За N-кінцевим доменом ідуть чотири трансмембранних домени (ТМ1-4), серед яких ТМ2 створює внутрішню вистілку пори іонного каналу. Між доменами ТМ3 та ТМ4 знаходиться велика внутрішньоклітинна ділянка, що містить сайти, які фосфорилюються за допомогою протеїнкіназ, а також місця приєднання численних якірних та регуляторних білків[6]. За доменом ТМ4 розташований дуже короткий С-кінцевий домен. Загалом, кількість амінокислотних залишків, котрі складають третинну структуру однієї субодиниці, дорівнює приблизно 400[5](англ.).
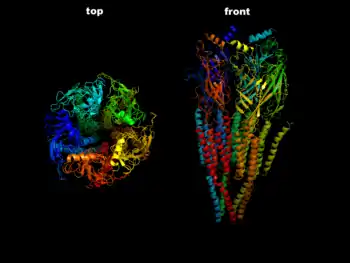
Велика кількість типів субодиниць ГАМКA-рецептора (загалом 16) призводить до великої кількості структурно відмінних ГАМКA-рецепторів, що можуть бути теоретично ними сформовані. Але практично in vivo рівень різноманіття функціональних ГАМКA-рецепторів є набагато меншим. Завдяки комплексним молекулярно-біологічним дослідженням було встановлено, які саме комбінації субодиниць можуть формувати функціональні ГАМКA-рецептори — див. Таблицю 1. При цьому треба завважити, що не всі штучно синтезовані нормальні функціональні форми рецепторів, наведені в таблиці, на початок 2000-х років знайдені в мозку[7][8].
Таблиця 1. Форми ГАМКA-рецепторів, знайдені в нервовій системі
| Комбінація субодиниць | Розповсюдження та властивості |
|---|---|
| α1βγ2 | Найзвичайніша ізоформа, ~40% від усіх ГАМКA-рецепторів; широко розповсюджена в хімічних синапсах нервової системи |
| α2βγ2 | Досить звичайна, також широко розповсюджена |
| α3βγ2 | Не така звичайна як дві попередні, широко розповсюджена |
| α4βγ2/δ | Відносно рідкісна, знайдена в гіпокампі та таламусі. Можливо, є позасинаптичним рецептором |
| α5βγ2 | Відносно рідкісна, знайдена в гіпокампі |
| α6βγ2/δ | Знайдена лише в гранулярному шарі мозочка та в нервових клітинах равлику вуха. Можливо, є позасинаптичним рецептором |
| α1α2-6βγ2 | Рецептори, що містять дві різні форми α-субодиниці, вірогідно, є дуже рідкісними, якщо взагалі така комбінація здатна формувати функціональний рецептор. Про їхнє існування можна стверджувати, ґрунтуючись на результатах імунних реакцій з використанням селективних сироваток |
| α2α3-6βγ2 | Відносно рідкісна, якщо взагалі здатна формувати функціональні рецептори. |
| α3α4-6βγ2 | Відносно рідкісна, якщо взагалі здатна формувати функціональні рецептори. |
Дослідження за допомогою кріоелектронної мікроскопії, проведені наприкінці 2010-х років, дозволили отримати зображення субодиниць рецептору в дуже високій роздільній здатності. Також було уточнено місця приєднання різноманітних лігандів рецептору[9].
У комах, зокрема дрозофіли, виявлено 3 гени, що кодують різні ізоформи ГАМКA-рецепторів[10]:
- Rdl (англ. resistance to dieldrin)
- Grd (англ. GABA and glycine-like receptor of Drosophila)
- Lcch3 (англ. ligand-gated chloride channel homologue3)
Функціональні властивості
Дослідження рекомбінантних ГАМКA-рецепторів показали, що функціональні властивості ГАМКA-рецепторів багато в чому визначаються складом субодиниць рецептора. Загалом, наступні закономірності можуть вважатись доведеними:
- Відсутність β-субодиниці в складі рецептора помітно зменшує, або навіть повністю блокує, чутливість до ГАМК;
- Створення комбінацій α-β збільшує чутливість до ГАМК, але отримані таким чином канали мають відносно низьку провідність (12-18 pS). Також ці рецептори нечутливі до бенздіазепінів, і можуть бути інгібійованими за допомогою низьких концентрацій Zn2+ (~100-200 нМ);
- Залучення γ-субодиниці, що призводить до формування комбінацій α-β-γ, незначно знижує чутливість до ГАМК порівняно з α-β — рецепторами; також таким рецепторам притаманна алостерична модуляція бенздіазепінами, і помітно менша чутливість до іонів Zn2+ (~200-500 μМ). Провідність іонного каналу у рецепторів з таким складом субодиниць приблизно на 30 % вища (28-31 pS), аніж у форм α-β. Наявність субодиниці γ2, окрім того, стимулює формування кластерів (тісних груп) рецепторів на постсинаптичній мембрані хімічних синапсів.
ГАМКА-рецептори комах відрізняються за фармакологічними властивостями від рецепторів ссавців. Вони часто є мішенями для інсектицидів.[10]
Таблиця 2. Властивості ГАМКA-рецепторів
| Природний агоніст | ГАМК |
| Селективний агоніст | Ізогувацин |
| Антагоніст | Пікротоксин |
| Селективний антагоніст | Бікукуллін[11] |
| Модулятори: бенздіазепіни | Потенціювання |
| Барбітурати | Потенціювання |
| Іони Zn2+2+ (IC50) | Інгібіювання (αβ — 100-500nM; αβγ — 100-500mM) |
| Нейростероїди | Потенціювання/інгібіювання |
| Ефективність ГАМК (ЕС50) | 2-30μM |
| Іони, що проходять через канал | Cl- та НСО3- |
| Активація рецептора | Швидка (мілісекунди) |
| Десенситизація | Швидка та глибока |
| Провідність каналу | 25-32pS |
Місце зв'язування ГАМК
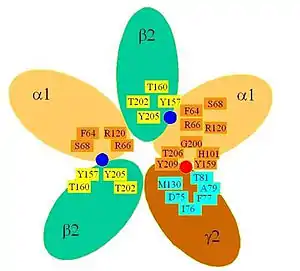
На початок 2000-х вважалося, що до складу ділянки зв'язування ГАМК на ГАМКA-рецепторі входять амінокислотні залишки як з α-, так і з β-субодиниці. При цьому в складі β-субодиниці для формування ділянки зв'язування ГАМК критичними є два домени, що містять амінокислоти YGYT (однолітерний код, див статтю «амінокислота») — залишки 157—160 субодиниці β2 (тут і далі літера позначає однолітерний код амінокислоти, цифра — номер залишку в ланцюгу білкової молекули, починаючи від N-кінця); і, також, YGSY — залишки 202—205. Втім, згідно з деякими теоріями[якими?], останній домен може бути асоційованим з механізмом конформаційної передачі в процесі відкриття іонного каналу, а не власне з ділянкою зв'язування ГАМК. Перераховані вище залишки взаємодіють із залишками F64, R66, S68, R120 субодиниці α1 — таким чином, ділянка зв'язування ГАМК сформована на поверхні контакту α- та α-субодиниць[12].
Алостерична модуляція: бенздіазепінова ділянка
Дослідження рекомбінантних рецепторів показали, що одночасна наявність α- та γ-субодниць є необхідною для можливості алостеричного регулювання ГАМКA-рецептора за допомогою бенздіазепінів. При цьому були ідентифіковані декілька критично важливих амінокислотних залишків — Н101 в α1-субодиниці та F77 в γ2-субодиниці — які впливають на активність зв'язування[13].
Окрім того, важливу роль відіграє залишок Т142 в субодиниці γ2, котрий впливає на ефективність бенздіазепінів. Цікаво, що залишок F77 в субодиниці γ2 є гомологічним до F64 в субодиниці α1, що завдає активного впливу на ефект ГАМК. Таким чином, сайт зв'язування бенздіазепінів, локалізований на поверхні між субодиницями α та γ, може бути таким, що еволюційно виник із ділянки зв'язування агоністу (тобто ГАМК)[8].
Набір субодиниць, що формує нативний рецептор, особливо що стосується різних ізоформ γ та α субодиниць, може завдавати вплив і на фармакологію бенздіазепінів. Ліганди бенздіазепінового ряду можуть діяти як часткові або повні агоністи, потенціюючи дію ГАМК; як антагоністи, котрі не мають жодного впливу на дію ГАМК, але запобігають дії агоністів-бенздіазепінів; та як часткові або повні зворотні агоністи, котрі інгібіюють активацію рецептора задопомогою ГАМК, діючи на бенздіазепінову ділянку. Ефекти зворотніх агоністів можуть бути інгібійовані антагоністами бенздіазепінового ряду. Рецептори, що містять α1- та βіγ2 субодиниці (де і=1-3), мають високу спорідненість до бенздіазепінів, діазепаму, CL218872, та золпідему (часто називаються рецепторами або лігандами першого типу). CL218872 та золпідем мають набагато нижчу спорідненість до рецепторів, що містять α2-α3 та α5βіγ2 субодиниці (рецептори другого типу). Наступна група рецепторів, α4- та α6βіγ2 — рецептори, є діазепам-нечутливою, але здатною зв'язувати частковий зворотний агоніст, Ro-15-4513. У субодиницях α4 та α6 відсутній критично важливий для α1 амінокислотний залишок Н101, котрий замінений на агрінін. Такі діазепам-нечутливі рецептори називаються рецепторами третього типу.[13][14]
β-субодиниці та іонний канал
β-субодиниці рецептора спочатку вважались фармакологічно пасивними; тим не менше, нещодавні дослідження[які?] показали, що їхня наявність у складі нативного рецептора є критично необхідною умовою для його функціонування, а різні конформації β-субодиниць можуть впливати на ефект лігандів, які з цими субодиницями безпосередньо не зв'язуються (наприклад, на ефекти лореклезола). В усіх відомих на теперішній час випадках впливу на ефекти лігандів ГАМКA-рецептора з боку його β-субодиниць різниця в рецепторній відповіді зумовлена мутаціями (тобто замінами) одного і того ж амінокислотного залишку — на позиції 290 в сегменті ТМ2. У випадку β1-субодиниці це місце займає серин, і ефект лореклезолу при цьому не змінюється або інгібіюється; у випадку β2-субодиниці на цьому місці знаходиться аспарагін, що помітно потенціює (збільшує) ефект лореклезолу і ряду інших сполук.
Інший залишок, що сильно впливає на чутливість αβ-вмісних ГАМКA-рецепторів — це Н267, що знаходиться на зовнішній частині домену ТМ2. Цей залишок гістидину формує частину ділянки зв'язування Zn2+, роблячи рецептор чутливим до інгібіювання іонами цинку в концентрації близько 100 нМ. Локалізація цього амінокислотного залишку всередині хлорного каналу рецептру і той факт, що двовалентний катіон цинку може проникати в канал, пристосований для проходження одновалентних аніонів, незалежно від того, активований рецептор чи ні, є ознаками локалізації іон-селективної частини рецепторної молекули та механізму відкриття каналу на протилежному кінці рецептора.
Медичне значення
Мутації в генах субодиниць ГАМКА-рецепторів, а також інші порушення роботи цих білків призводять до низки захворювань, зокрема епілепсії, тривожних розладів, алкоголізму[15].
У клініці використовуються активатори цих рецепторів. Серед активаторів популярні транквілізатори, що належать до групи бензодіазепінів (алпразолам, гідазепам, діазепам, лоразепам, хлордіазепоксид тощо) та барбітуратів (фенобарбітал, тіопентал натрію тощо). Також активаторами рецепторів є пропофол, мусцимол тощо. Їх приймають як заспокійливі засоби, для розслаблення м'язів тощо. Інгібітори ГАМКА-рецепторів як бікукулін, габазін та інші практично не мають клінічного застосування, оскільки є потужними конвульсантами.
Див. також
Примітки
- Macdonald, R.L.; Gallagher, M.J. (2014). GABAA Receptor Channels; Properties and Regulation. с. 375–382. doi:10.1016/B978-0-12-385157-4.00042-7.
- Bormann, Joachim (2000). The ‘ABC’ of GABA receptors. Trends in Pharmacological Sciences 21 (1): 16–19. ISSN 01656147. doi:10.1016/S0165-6147(99)01413-3.(англ.)
- Sigel, Erwin; Steinmann, Michael E. (2012). Structure, Function, and Modulation of GABAA Receptors. Journal of Biological Chemistry 287 (48): 40224–40231. ISSN 00219258. doi:10.1074/jbc.R112.386664.(англ.)
- Jones, A.; Korpi, E. R.; McKernan, R. M.; Pelz, R.; Nusser, Z.; Mäkelä, R.; Mellor, J. R.; Pollard, S.; Bahn, S.; Stephenson, F. A.; Randall, A. D.; Sieghart, W.; Somogyi, P.; Smith, A. J. H.; Wisden, W. (1997). Ligand-Gated Ion Channel Subunit Partnerships: GABAAReceptor α6Subunit Gene Inactivation Inhibits δ Subunit Expression. The Journal of Neuroscience 17 (4): 1350–1362. ISSN 0270-6474. doi:10.1523/JNEUROSCI.17-04-01350.1997.(англ.)
- Smith, Geoffrey B.; Olsen, Richard W. (1995). Functional domains of GABAA receptors. Trends in Pharmacological Sciences 16 (5): 162–168. ISSN 01656147. doi:10.1016/S0165-6147(00)89009-4.
- Moss, Stephen J.; Smart, Trevoe G. (1996). Modulation Of Amind Acid-Gated Ion Channels By Protein Phoshorlation 39. с. 1–52. ISSN 00747742. doi:10.1016/S0074-7742(08)60662-5.(англ.)
- Fritschy, Jean-Marc; Mohler, Hanns (1995). GABAA-receptor heterogeneity in the adult rat brain: Differential regional and cellular distribution of seven major subunits. The Journal of Comparative Neurology 359 (1): 154–194. ISSN 0021-9967. doi:10.1002/cne.903590111.(англ.)
- Rabow, Lois E.; Russek, Shelley J.; Farb, David H. (1995). From ion currents to genomic analysis: Recent advances in GABAA receptor research. Synapse 21 (3): 189–274. ISSN 0887-4476. doi:10.1002/syn.890210302.(англ.)
- Kasaragod, Vikram Babu; Schindelin, Hermann (2019). Structure of Heteropentameric GABAA Receptors and Receptor-Anchoring Properties of Gephyrin. Frontiers in Molecular Neuroscience 12. ISSN 1662-5099. doi:10.3389/fnmol.2019.00191.(англ.)
- Hosie, Alastair; Sattelle, David; Aronstein, Kate; ffrench-Constant, Richard (1997). Molecular biology of insect neuronal GABA receptors. Trends in Neurosciences 20 (12): 578–583. ISSN 01662236. doi:10.1016/S0166-2236(97)01127-2.(англ.)
- Feigenspan, Andreas; Wässle, Heinz; Bormann, Joachim (1993). Pharmacology of GABA receptor CI− channels in rat retinal bipolar cells. Nature 361 (6408): 159–162. ISSN 0028-0836. doi:10.1038/361159a0.(англ.)
- Whiting, Paul J.; McKernan, Ruth M.; Wafford, Keith A. (1995). Structure and Pharmacology of Vertebrate GABAA Receptor Subtypes 38. с. 95–138. ISSN 00747742. doi:10.1016/S0074-7742(08)60525-5.(англ.)
- Rudolph, Uwe; Crestani, Florence; Benke, Dietmar; Brünig, Ina; Benson, Jack A.; Fritschy, Jean-Marc; Martin, James R.; Bluethmann, Horst та ін. (1999). Benzodiazepine actions mediated by specific γ-aminobutyric acidA receptor subtypes. Nature 401 (6755): 796–800. ISSN 0028-0836. doi:10.1038/44579.
- Korpi, Esa R; Gründer, Gerhard; Lüddens, Hartmut (2002). Drug interactions at GABAA receptors. Progress in Neurobiology 67 (2): 113–159. ISSN 03010082. doi:10.1016/S0301-0082(02)00013-8.(англ.)
- Шуба, 2010, с. 65.
Джерела
- Шуба, Я. М. (2010). Основи молекулярної фізіології іонних каналів: навчальний посібник для студентів вищих навчальних закладів. К.: Наукова думка. с. 60–66. ISBN 978-966-00-1042-0.
- Macdonald, R.L.; Gallagher, M.J. (2014). GABAA Receptor Channels; Properties and Regulation. с. 375–382. doi:10.1016/B978-0-12-385157-4.00042-7.
- Sigel, Erwin; Steinmann, Michael E. (2012). Structure, Function, and Modulation of GABAA Receptors. Journal of Biological Chemistry 287 (48): 40224–40231. ISSN 00219258. doi:10.1074/jbc.R112.386664.(англ.)
- Bormann, Joachim (2000). The ‘ABC’ of GABA receptors. Trends in Pharmacological Sciences 21 (1): 16–19. ISSN 01656147. doi:10.1016/S0165-6147(99)01413-3.(англ.)
- Feigenspan, Andreas; Wässle, Heinz; Bormann, Joachim (1993). Pharmacology of GABA receptor CI− channels in rat retinal bipolar cells. Nature 361 (6408): 159–162. ISSN 0028-0836. doi:10.1038/361159a0.(англ.)
- Fritschy, Jean-Marc; Mohler, Hanns (1995). GABAA-receptor heterogeneity in the adult rat brain: Differential regional and cellular distribution of seven major subunits. The Journal of Comparative Neurology 359 (1): 154–194. ISSN 0021-9967. doi:10.1002/cne.903590111.(англ.)
- Hosie, Alastair; Sattelle, David; Aronstein, Kate; ffrench-Constant, Richard (1997). Molecular biology of insect neuronal GABA receptors. Trends in Neurosciences 20 (12): 578–583. ISSN 01662236. doi:10.1016/S0166-2236(97)01127-2.(англ.)
- Jones, A.; Korpi, E. R.; McKernan, R. M.; Pelz, R.; Nusser, Z.; Mäkelä, R.; Mellor, J. R.; Pollard, S.; Bahn, S.; Stephenson, F. A.; Randall, A. D.; Sieghart, W.; Somogyi, P.; Smith, A. J. H.; Wisden, W. (1997). Ligand-Gated Ion Channel Subunit Partnerships: GABAAReceptor α6Subunit Gene Inactivation Inhibits δ Subunit Expression. The Journal of Neuroscience 17 (4): 1350–1362. ISSN 0270-6474. doi:10.1523/JNEUROSCI.17-04-01350.1997.(англ.)
- Korpi, Esa R; Gründer, Gerhard; Lüddens, Hartmut (2002). Drug interactions at GABAA receptors. Progress in Neurobiology 67 (2): 113–159. ISSN 03010082. doi:10.1016/S0301-0082(02)00013-8.(англ.)
- Moss, Stephen J.; Smart, Trevoe G. (1996). Modulation Of Amind Acid-Gated Ion Channels By Protein Phoshorlation 39. с. 1–52. ISSN 00747742. doi:10.1016/S0074-7742(08)60662-5.(англ.)
- Rabow, Lois E.; Russek, Shelley J.; Farb, David H. (1995). From ion currents to genomic analysis: Recent advances in GABAA receptor research. Synapse 21 (3): 189–274. ISSN 0887-4476. doi:10.1002/syn.890210302.(англ.)
- Rudolph, Uwe; Crestani, Florence; Benke, Dietmar; Brünig, Ina; Benson, Jack A.; Fritschy, Jean-Marc; Martin, James R.; Bluethmann, Horst та ін. (1999). Benzodiazepine actions mediated by specific γ-aminobutyric acid A receptor subtypes. Nature 401 (6755): 796–800. ISSN 0028-0836. doi:10.1038/44579. (англ.)
- Smith, Geoffrey B.; Olsen, Richard W. (1995). Functional domains of GABAA receptors. Trends in Pharmacological Sciences 16 (5): 162–168. ISSN 01656147. doi:10.1016/S0165-6147(00)89009-4.(англ.)
- Whiting, Paul J.; McKernan, Ruth M.; Wafford, Keith A. (1995). Structure and Pharmacology of Vertebrate GABAA Receptor Subtypes 38. с. 95–138. ISSN 00747742. doi:10.1016/S0074-7742(08)60525-5.(англ.)
