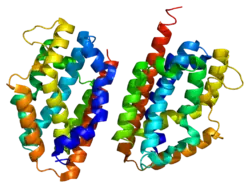
Гемоксигеназа-2
HMOX2 (англ. Heme oxygenase 2) – білок, який кодується однойменним геном, розташованим у людей на короткому плечі 16-ї хромосоми.[3] Довжина поліпептидного ланцюга білка становить 316 амінокислот, а молекулярна маса — 36 033[4].
Послідовність амінокислот
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MSAEVETSEG | VDESEKKNSG | ALEKENQMRM | ADLSELLKEG | TKEAHDRAEN | ||||
| TQFVKDFLKG | NIKKELFKLA | TTALYFTYSA | LEEEMERNKD | HPAFAPLYFP | ||||
| MELHRKEALT | KDMEYFFGEN | WEEQVQCPKA | AQKYVERIHY | IGQNEPELLV | ||||
| AHAYTRYMGD | LSGGQVLKKV | AQRALKLPST | GEGTQFYLFE | NVDNAQQFKQ | ||||
| LYRARMNALD | LNMKTKERIV | EEANKAFEYN | MQIFNELDQA | GSTLARETLE | ||||
| DGFPVHDGKG | DMRKCPFYAA | EQDKGALEGS | SCPFRTAMAV | LRKPSLQFIL | ||||
| AAGVALAAGL | LAWYYM |
Кодований геном білок за функціями належить до оксидоредуктаз, фосфопротеїнів. Задіяний у таких біологічних процесах, як ацетилювання, альтернативний сплайсинг. Білок має сайт для зв'язування з іонами металів, іоном заліза, гемом. Локалізований у ендоплазматичному ретикулумі, мікросомах.
Література
- Ishikawa K. (1995). Heme oxygenase-2. Properties of the heme complex of the purified tryptic fragment of recombinant human heme oxygenase-2.. J. Biol. Chem. 270: 6345 — 6350. PubMed DOI:10.1074/jbc.270.11.6345
- McCoubrey W.K. Jr., Ewing J.F., Maines M.D. (1992). Human heme oxygenase-2: characterization and expression of a full-length cDNA and evidence suggesting that the two HO-2 transcripts may differ by choice of polyadenylation signal.. Arch. Biochem. Biophys. 295: 13 — 20. PubMed DOI:10.1016/0003-9861(92)90481-B
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Bianchetti C.M., Yi L., Ragsdale S.W., Phillips G.N. Jr. (2007). Comparison of apo- and heme-bound crystal structures of a truncated human heme oxygenase-2.. J. Biol. Chem. 282: 37624 — 37631. PubMed DOI:10.1074/jbc.M707396200
Примітки
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:5014 (англ.). Процитовано 11 вересня 2017.
- UniProt, P30519 (англ.). Процитовано 11 вересня 2017.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.