Дифеніл
Дифені́л, біфені́л — органічна сполука, вуглеводень, здвоєний фенільний радикал. Являє собою білі кристали.
| Дифеніл | |
|---|---|
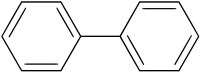 | |
 | |
| Інші назви | біфеніл |
| Ідентифікатори | |
| Номер CAS | 92-52-4 |
| Номер EINECS | 202-163-5 |
| KEGG | C06588 |
| ChEBI | 17097 |
| RTECS | DU8050000 |
| SMILES |
C1=CC=C(C=C1)C2=CC=CC=C2[1] |
| InChI |
InChI=1S/C12H10/c1-3-7-11(8-4-1)12-9-5-2-6-10-12/h1-10H |
| Номер Бельштейна | 1634058 |
| Номер Гмеліна | 3808 |
| Властивості | |
| Молекулярна формула | C12H10 |
| Молярна маса | 154,207 г/моль |
| Зовнішній вигляд | біла речовина |
| Густина | 1,04 г/см³[2][3] |
| Тпл | 68,93 °C[3] |
| Ткип | 256,1 °C[3] |
| Розчинність (вода) | 0,0072 г/л[4][3] |
| Діелектрична проникність (ε) | 2,53[5] |
| Показник заломлення (nD) | 1,588[6] |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
99,4 кДж/моль[7][8] |
| Ст. ентропія S |
209,4 Дж/(моль·K)[7] |
| Теплоємність, c |
198,4 (Дж/моль·K)[7] |
| Небезпеки | |
| Температура спалаху | 113 °C |
| Температура самозаймання | 540 °C |
| Вибухові границі | 0,6—5,8% |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Використовується як високотемпературний теплоносій, а також харчовий консервант (фунгіцид).
Фізичні властивості
Чистий дифеніл являє собою білі моноклінні кристали зі специфічним запахом, легкий жовтий відтінок свідчить про появу у сполуці домішок. Не розчинний у воді, розчинний в більшості органічних розчинників (в етанолі, бензені, діетиловому етері).
Отримання
Дифеніл був відкритий у 1862 році Георгом Віттігом реакцією бромобензену із натрієм (реакція Вюрца):
У 1867 році Марселен Бертло синтезував дифеніл, пропускаючи пару бензену крізь розжарену трубку:
Зараз дифеніл отримують, в основному, як побічний продукт гідродеалкілювання толуену (головним продуктом є бензен). Реакція проводиться при температурі 700 °C і тиску 4 МПа:
До 1970-х років застосовувався метод термальної дегідроконденсації бензену. Подібно до способу Бертло, пара бензену протягом кількох секунд пропускалася крізь трубку розгрітої до 700—850 °C електропечі. Цим методом вдавалося досягти високої чистоти кінцевого продукту — до 99,5%. Окрім дифенілу, могли також утворюватися поліфеніли складу C6H5-(C6H4)n-C6H5. Основною технічною проблемою цього способу виявилося надмірне утворення сажі на стінках трубки. Для її усунення додається 0,1% добавок оксигено- та сульфуровмісних сполук (метанолу, сірковуглецю).
Застосовуються також інші методи добування дифенілу: піроліз кам'яновугільної смоли, гідродимеризація бензену (утворення фенілциклогексану і дегідрування його до дифенілу):
Хімічні властивості
Слабко вступає в реакції, характерні для ароматичних вуглеводнів (нітрування, хлорування, сульфування і т. д.). Заміщення відбувається у 2 та 4 положеннях. Алкілювання за реакцією Фріделя — Крафтса переважає за 4 положенням.
Застосування
Дифеніл широко застосовується як високотемпературний теплоносій: його суміші з дифеніловим етером зареєстровані як торгові марки «Diphyl», «Dowtherm», «Gilotherm» та ін.
Сполука використовується як прекурсор для синтезу галогенопохідних дифенілу (поліхлоробіфенілів та полібромобіфенілів), які є барвниками.
Проявляє фунгіцидні властивості, дифенілом вкривають упаковку продуктів у разі їхнього тривалого транспортування. У класифікації харчових добавок дифеніл має номер E230.
Див. також
Примітки
- Biphenyl
- При 20 °C
- За тиску 101,3 кПа
- При 25 °C
- При 75 °C
- При 77 °C
- Для твердого агрегатного стану
- Теплота утворення газуватого дифенілу складає 181,4 кДж/моль
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Paetz C. Hydrocarbons // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 37—39. — DOI: (англ.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.