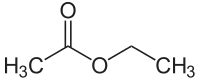
Етилацетат
Ети́лацета́т — органічна сполука ряду естерів. Має хімічний склад CH3COOC2H5 і умовно розглядається як продукт взаємодії етанолу та оцтової кислоти. За звичайних умов є безбарвною рідиною з приємним, фруктовим запахом. Добре розчиняється у воді, необмежено змішується з етанолом.
| Етилацетат | |
|---|---|
 | |
 | |
| Назва за IUPAC | етилацетат |
| Інші назви | оцтовоетиловий естер, етил ацетат |
| Ідентифікатори | |
| Номер CAS | 141-78-6 |
| Номер EINECS | 205-500-4 |
| KEGG | D02319 і C01883 |
| ChEBI | 27750 |
| RTECS | AH5425000 |
| SMILES |
CCOC(=O)C[1] |
| InChI |
InChI=1S/C4H8O2/c1-3-6-4(2)5/h3H2,1-2H3 |
| Номер Бельштейна | 506104 |
| Номер Гмеліна | 26306 |
| Властивості | |
| Молекулярна формула | C4H8O2 |
| Молярна маса | 88,106 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Запах | фруктовий |
| Густина | 0,9003 г/см³ (20 °C) |
| Тпл | -83,8 °C |
| Ткип | 77,11 °C |
| Розчинність (вода) | 87,9 г/л |
| Діелектрична проникність (ε) | 6,081 (20 °C) |
| Показник заломлення (nD) | 1,3723 (20 °C) |
| В'язкість | 0,423 мПа·с |
| Дипольний момент | 1,78 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-479,3 кДж/моль (рід.) 443,6 кДж/моль (газ) |
| Ст. ентропія S |
257,7 Дж/(моль·K) (рід.) 362,8 Дж/(моль·K) (газ) |
| Теплоємність, c |
170,7 Дж/(моль·K) (рід.) 113,6 Дж/(моль·K) (газ) |
| Небезпеки | |
| Температура спалаху | -4 °C |
| Температура самозаймання | 426 °C |
| Вибухові границі | 2—11,5% |
| Пов'язані речовини | |
| Пов'язані речовини | етанол, оцтова кислота |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Широко застосовується як розчинник у виробництв покриттів, адгезивів, лікарських засобів, а також як екстрагент у харчовій промисловості.
Фізичні властивості

Етилацетат є безбарвною рідиною із фруктовим запахом. Він утворює азеотропну суміш з водою, яка кипить при 70,38 °C і містить 8,47% води та 91,53% естеру. Виділення етилацетату з водно-етанольного розчину відбувається у вигляді азеотропної суміші естер-спирт-вода, яка кипить за 70,2 °C і містить 9,0% води, 8,4% етанолу і 82,6% естеру.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 0,9245 | 0,9126 | 0,9006 | 0,8884 | 0,8759 | 0,8632 | 0,8503 | 0,8370 | 0,8234 | 0,8095 | 0,7952 |
| 0 °C | 25 °C | 50 °C | 75 °C |
|---|---|---|---|
| 0,578 | 0,423 | 0,325 | 0,259 |
Отримання
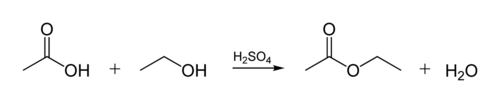
Основним застосовуваним методом для синтезу етилацетату є взаємодія оцтової кислоти та етанолу (естерифікація):
Виділення естеру з реакційної суміші відбувається у вигляді азеотропної суміші естер-спирт-вода. Після декантації та очищення кінцевий вихід продукту складає 95%.
Оцтова кислота є порівняно слабким ацилюючим агентом, тому для збільшення ефективності синтезу застосовують хлороангідрид кислоти:
Для зв'язування утвореного хлороводню в реакційну суміш додають третинний амін (наприклад, піридин).
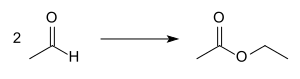
Іншим способом є реакція Тищенка за участі етаналю:
Взаємодія проходить у неводному середовищі при низькій температурі (0—5 °C) та у присутності каталізатору, наприклад, алкоксиду алюмінію Al(OR)3 або титану Ti(OR)4 (R — алкільний замісник).
Хімічні властивості
Етилацетат зазнає гідролізу, утворюючи оцтову кислоту і етанол. Розпад естеру пришвидшується у присутності кислот або основ:
Як типовий естер, етилацетат може реагувати із реактивами Гріньяра із утворенням третинних спиртів:
Під дією сильних відновників, таких як борогідриди або алюмогідриди лужних металів, естер відновлюється до первинного спирту:
Застосування
Етилацетат є поширеним розчинником у виготовленні покриттів, адгезивних матеріалів, чорнила, косметики, фармацевтичних препаратів. При виробництві кави без кофеїну його застосовують як екстрагент.
Примітки
- ETHYL ACETATE
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Sakamuri, R. Esters, Organic // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 9. — P. 386—398. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Cheung, H., Tanke, R. S., Torrence, G. P. Acetic Acid // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 21—22. — DOI: (англ.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.