Карбонатна кислота
Карбона́тна кислота́, також ву́гільна, вуглецева кислота́ (вуглекислота) — слабка двоосновна кислота з хімічною формулою H2CO3. У чистому вигляді нестійка[1]. Утворюється в малих кількостях при розчиненні вуглекислого газу у воді, в тому числі і вуглекислого газу з повітря. Утворює ряд стійких неорганічних та органічних похідних: солі (карбонати та гідрокарбонати), естери, аміди та ін
| Карбонатна кислота | |
|---|---|
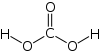 Структурна формула |
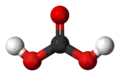 Кулестрижнева модель |
| Назва за IUPAC | Карбонатна кислота |
| Інші назви | Вугільна кислота; дигідрогенкарбонат; гідроксиметанова кислота |
| Ідентифікатори | |
| Номер CAS | 463-79-6 |
| Номер EINECS | 610-295-3 |
| KEGG | C01353 |
| ChEBI | 28976 |
| SMILES |
O=C(O)O |
| InChI |
1/CH2O3/c2-1(3)4/h(H2,2,3,4) |
| Номер Гмеліна | 25554 |
| Властивості | |
| Молекулярна формула | H2CO3 |
| Молярна маса | 62,03 г/моль |
| Розчинність (вода) | Існує лише в розчині |
| Кислотність (pKa) | 6,367 (pKa1), 10,329 (pKa2) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Молекула вугільної кислоти має плоску будову. Центральний вуглецевий атом має sp²-гібридизацію. У гідрокарбонат- карбонат-аніонів відбувається делокалізація π-зв'язку. Довжина зв'язку C—O в карбонат-іоні становить 129 пм.
Хімічні властивості
Рівновага у водних розчинах та кислотність
Вугільна кислота існує у водних розчинах в стані рівноваги з гідратом діоксиду вуглецю:
- , константа рівноваги при 25 °C
Швидкість прямої реакції 0,039 з−1, зворотної — 23 з−1.
У свою чергу розчинений гідрат діоксиду вуглецю знаходиться в рівновазі з газоподібним діоксидом вуглецю:
- ]
Дана рівновагу при підвищенні температури зсувається вправо, а при підвищенні тиску — вліво (докладніше див. Абсорбція газів).
Вугільна кислота піддається оборотньому гідролізу, створюючи при цьому кисле середовище:
- , константа кислотної дисоціації при 25 °C
Однак, для практичних розрахунків частіше використовують уявну константу кислотності, що враховує рівновагу вугільної кислоти з гідратом діоксиду вуглецю:
гідрокарбонат-іон піддається подальшому гідролізу по реакції
- , константа кислотності при 25 °C
Таким чином, в розчинах, що містять вугільну кислоту, створюється складна рівноважна система, яку можна зобразити у загальному вигляді таким чином:
Значення pH в такій системі, яке відповідає насиченому розчину діоксиду вуглецю в воді при 25 °C і тиску 760 мм рт. ст., можна розрахувати по формулі:
- , где L = 0,034 моль/л — розчинність CO2 в воді при вказаних умовах.
Розкладання
При збовтуванні, підвищенні температури розчину і/або пониженні парціального тиску діоксиду вуглецю рівновагу в системі зміщується вліво, що призводить до розкладання частини вугільної кислоти на воду і діоксид вуглецю. При кипінні розчину вугільна кислота розкладається повністю:
Взаємодія з основами та солями
Вугільна кислота вступає в реакції нейтралізації з розчинами основ, утворюючи середні та кислі солі (хімія) — карбонати та гідрокарбонати відповідно:
- (конц.) ]
- (розч.) ]
- ]
- ]
При взаємодії вугільної кислоти з карбонатами утворюються гідрокарбонати:
Отримання
Вугільна кислота утворюється при розчиненні у воді діоксиду вуглецю:
Вміст вугільної кислоти в розчині збільшується при зниженні температури розчину та збільшенні тиску вуглекислого газу.
Також вугільна кислота утворюється при взаємодії її солей (карбонатів та гідрокарбонатів) з більш сильною кислотою. При цьому велика частина утворилася вугільної кислоти, як правило, розкладається на воду і діоксид вуглецю:
Застосування
Вугільна кислота завжди присутня у водних розчинах вуглекислого газу (див. Газована вода).
В біохімії використовується властивість рівноважної системи змінювати тиск газу пропорційно зміні змісту іонів оксонію (кислотності) при постійній температурі. Це дозволяє реєструвати в реальному часі хід ферментативних реакцій, що протікають із зміною pH розчину.
Органічні похідні
Вугільну кислоту формально можна розглядати як карбонову кислоту з гідроксильною групою замість вуглеводневої залишку. У цій якості вона може утворювати всі похідні, характерні для карбонових кислот[2].
Деякі представники подібних сполук перераховані в таблиці.
| Клас сполук | Приклад сполук |
|---|---|
| Естери | полікарбонат |
| Хлороангідриди | фосген |
| Аміди | сечовина |
| Нітрили | ціанові кислоти |
| Ангідриди | піровуглецева кислота |
Див. також
Примітки
- Вугільна кислота тепер виявлена і в газовій фазі — пора знову переписувати підручники[недоступне посилання з липня 2019]
- Нейланд О. Я. Органічна хімія. — М. : Вища школа, 1990. — С. 640 — 652. — ISBN 5-06-001471-1.
Література
- Функціональні похідні карбонових та вугільної кислот : Навч. посіб. для студ. хім. спец. ун-тів / М. І. Ганущак, В. В. Карп'як; Львів. нац. ун-т ім. Івана Франка. - Л., 2002. - 292 c. - Бібліогр.: 25 назв.
- Лидин Р. А., Молочко В. А., Андрєєва Л. Л. Реакции неорганических соединений: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М. : Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2. (рос.)
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических соединений: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М. : Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5. (рос.)
