Нітрили
Нітри́ли — клас органічних сполук, які мають у своїй структурі функціональну групу C≡N. В цій групі атоми Карбону та Нітрогену зв'язані потрійним зв'язком. Щоб показати присутність нітрильної групи в молекулі використовують префікс ціано-. Інколи групу -CN називають ціанідною або ціаногрупою, а сполуки, де вона міститься, — ціанідами.
Нітрили можуть утворювати дуже токсичний іон CN−.
Історія
Першу сполуку гомологічного ряду нітрилів — нітрил мурашиної кислоти — вперше синтезував Карл Вільгельм Шеєле в 1782 році[1]. У 1811 році Жозеф Луї Гей-Люссак зумів синтезувати летку і дуже отруйну чисту кислоту. Нітрили аренових кислот вперше синтезували Фрідріх Велер і Юстус фон Лібіх, але зважаючи на малі виходи синтезів не було досліджено фізико-хімічних властивостей і не запропоновано будь-якої структурної формули. Теофіл-Джулез Пелоуз у 1834 році синтезував пропіоновий нітрил, назвавши його етером пропіонового спирту і синильної кислоти.[2] Приготування бензонітрилу Германом Фелінгом у 1844 році шляхом нагрівання бензоату амонію, стало першим методом, який дозволив отримувати достатні для проведення хімічного аналізу кількості речовин. Він підтвердив структуру сполуки, порівнюючи свої результати з відомим на той час синтезом синильної кислоти, шляхом нагрівання форміату амонію. Для відкритої речовини він застосував термін нітрил, який дав назву цілій групі сполук[3].
Нітрили містяться в ряді рослинних та тваринних джерел. Зокрема їх зустрічають у фруктах, особливо в мигдалі.
Понад 120 природних нітрилів міститься в землі і в морі.
Отримання
Нітрили можна отримати органічним синтезом, за допомогою таких методів:
- Реакція нуклеофільного аліфатичного заміщення алкілгалогенідів метал ціанідами. Це синтез нітрилів Колбе. Арил нітрили готуються синтезом Розенмунда фон Брауна.
- Реакція дегідратації первинних амідів. При проведенні цієї реакції утворюються численні проміжні речовини. Етилдихлорофосфат та 1,8-Діазобіцикло[5.4.0]ундец-7-ен одні з багатьох на шляху перетворення бензаміду у бензонітрил[4]:
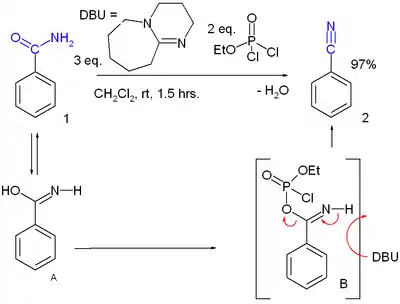
- Реакція дегідратації вторинних амідів (дегідратація амідів фон Брауна)
- Реакція дегідратації альдоксиму з тріетиламіном/діоксидом сірки чи цеолітами.
- Синтез за участю альдегіду з гідроксиламіном та сульфатом натрію.
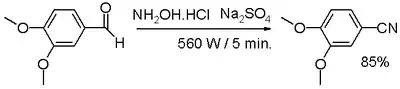
- В одну стадію[5] ароматичний чи аліфатичний альдегід реагує з гідроксиламіном та безводним сульфатом натрію в сухому середовищі, при короткотривалому мікрохвильовому опроміненню.
- Взаємодія метал ціанідів з альдегідами (ціаногідринова реакція).
- З арилкарбоксильних кислот (нітрильний синтез Летта).
- Ароматичні нітрили можна отримати з діазосполук реакцією Зандмеєра.
- З алкенів і алкінів гідроціануванням.
- В промисловості ціанідну групу отримують з ціаніду диетилалюмінію Et2AlCN, який одержують з триетилалюмінію та HCN[6].
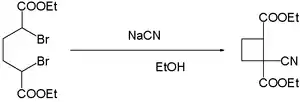
- Ціанід-іони полегшують сполучення дибромідів. Реакція α,α'-дибромоадипінової кислоти з ціанідом натрію в етанолі в результаті дає ціаноциклобутан[7].
Хімічні властивості
Нітрильні групи при відповідних умовах можуть вступати в різні реакції. Нітрильну групу можна гідролізувати, відновити чи відщепити від сполуки у вигляді ціанід-іону.
- Гідроліз нітрилів RCN протікає у кілька стадій в присутності кислоти чи основи з утворенням карбоксиламідів RC(=O)NH2, а згодом карбонових кислот. Гідроліз нітрилів вважається одним із найкращих методів одержання карбонових кислот. Однак ця реакція, каталізована основою або кислотою, має певні недоліки та/або перешкоди при приготуванні амідів. Головна перешкода полягає в кінцевій нейтралізації, як кислоти, так і основи, яка спричиняє потужне солеутворення з нестійким продуктом розкладу і забруднення кінцевого продукту. Також є такі обмеження: — Реакція каталізована основою. Кінетичні вивчення дозволили оцінити порівняльні швидкості гідратації кожної стадії реакції і, як типовий приклад, констант швидкості гідролізу, каталізованого гідроксид-іоном, ацетонітрилу та ацетаміду, які становлять 1,6·10-6 і 7,4·10-5 відповідно. Порівняння цих двох значень показало, що друга стадія гідролізу, каталізованого основою, проходить із більшою швидкістю ніж перша, і реакція радше проходитиме до кінцевого продукту гідратації (солі карбонової кислоти), ніж зупиниться на стадії утворення аміду. Це наводить на думку, що аміди, отримані реакцією, каталізованою основою, будуть забруднені карбоновими кислотами і їх можна виділити тільки в невеликих кількостях. — Реакції каталізовані кислотами. Використання розчинів сильних кислот вимагає ретельного контролю температури та співвідношень реагентів для запобігання утворення полімерів, які підвищують екзотермічний характер гідролізу[10].
- У реакції відновлення нітрил реагує з воднем в присутності нікелевого каталізатора. Продуктом цієї реакції є амін.
- У реакціях нуклеофільного приєднання нітрил є електрофілом:
- з цинковмісними органічними речовинами в реакції Блеізе;
- та зі спиртами в реакції Піннера.
- також, в реакції амінсаркозіну з ціанамідом, яка дає креатин[11]
- Нітрили реагують в ацилюванні Фріделя-Крафтса в реакції Гоубена — Гоеша до кетонів.
- В реакції відновного деціанування нітрильна група заміщується протоном[12].
- Нітрили самовільно реагують у присутності основ у реакції Торпе в нуклеофільному приєднанню.
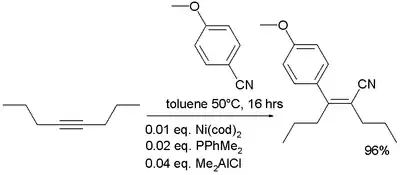
- В металоорганічній хімії нітрили відомі приєднанням до алкенів в карбоціануванні[13]:
Органічні ціанаміди
Ціанаміди — це N-ціано сполуки з загальною будовою R1R2N-CN і пов'язані з неорганічним джерелом ціанамідом. Для прикладу дивіться: реакція фон Брауна.
Вплив на живі організми
Нітрили — токсичні речовини, механізм дії яких пов'язаний зі здатністю порушувати функцію ферменту цитохромоксидази і які стримують процес перенесення кисню з крові до клітин організму. Отруєння може відбутися при вдиханні парів, при потраплянні в шлунково-кишковий тракт або через шкіру в організм.
Див. також
Примітки
- David T. Mowry (1948). The Preparation of Nitriles.. Chemical reviews 42 (2): 189–283. doi:10.1021/cr60132a001.[недоступне посилання з квітня 2019]
- J. Pelouze (1834). Notiz über einen neuen Cyanäther. Annalen der Chemie und Pharmacie 10 (2): 249. doi:10.1002/jlac.18340100302.
- Hermann Fehling (1844). Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme. Annalen der Chemie und Pharmacie 49 (1): 91–97. doi:10.1002/jlac.18440490106.
- Chun-Wei Kuo, Jia-Liang Zhu, Jen-Dar Wu, Cheng-Ming Chu, Ching-Fa Yao and Kak-Shan Shia (2007). A convenient new procedure for converting primary amides into nitriles. Chem. Commun. 2007: 301–303. doi:10.1039/b614061k.
- Sharwan K, Dewan, Ravinder Singh, and Anil Kumar (2006). One pot synthesis of nitriles from aldehydes and hydroxylamine hydrochloride using sodium sulfate (anhyd) and sodium bicarbonate in dry media under microwave irradiation (open access). Arkivoc: (ii) 41–44. Архів оригіналу за 26 вересня 2007. Процитовано 2 липня 2008.
- W. Nagata and M. Yoshioka (1988). Diethylaluminum cyanide. Org. Synth.; Coll. Vol. 6: 436.
- Reynold C. Fuson, Oscar R. Kreimeier, and Gilbert L. Nimmo (1930). Ring Closures In The Cyclobutane Series. Ii. Cyclization Of Α,Α′-Dibromo-Adipic Esters. J. Am. Chem. Soc. 52 (10): 4074–4076. doi:10.1021/ja01373a046.
- Über eine neue Methode zur Darstellung cyclischer Nitrile durch katalytischen Abbau (I. Mitteil.) (p 2464—2472) J. Houben, Walter Fischer Berichte der deutschen chemischen Gesellschaft (A and B Series) Volume 63, Issue 9 , Pages 2464—2472 DOI:10.1002/cber.19300630920
- http://www.drugfuture.com/OrganicNameReactions/ONR197.htm Merck & Co., Inc., Whitehouse Station
- V. Yu. Kukushkin, A. J. L. Pombeiro, Metal-mediated and metal-catalyzed hydrolysis of nitriles (a review), Inorg. Chim. Acta, 358 (2005) 1-21.
- Smith, Andri L.; Tan, Paula (2006). Creatine Synthesis: An Undergraduate Organic Chemistry Laboratory Experiment. J. Chem. Educ. 83: 1654.
- The reductive decyanation reaction: chemical methods and synthetic applications Jean-Marc Mattalia, Caroline Marchi-Delapierre, Hassan Hazimeh, and Michel Chanon Arkivoc (AL-1755FR) pp 90-118 2006 Article[недоступне посилання з квітня 2019]
- Yoshiaki Nakao, Akira Yada, Shiro Ebata, and Tamejiro Hiyama (2007). A Dramatic Effect of Lewis-Acid Catalysts on Nickel-Catalyzed Carbocyanation of Alkynes. J. Am. Chem. Soc. (Communication) 129 (9): 2428–2429. doi:10.1021/ja067364x.
Література
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0