Кеп
Кеп, 5'-кеп (вимовляється п'ять-штрих-кеп) або кеп-структура (від англ. cap — шапка) — структура на 5'-кінці матричних РНК (мРНК) та деяких інших РНК ядерних організмів. Кеп складається з одного чи декількох модифікованих нуклеотидів і характерний лише для транскриптів (молекул РНК, що утворюються внаслідок транскрипції), що синтезуються РНК-полімеразою II. Наявність кепу — одна з ознак, що відрізняють мРНК ядерних від мРНК доядерних, які містять трифосфат на 5'-кінці. Ця та інші відмінності обумовлюють суттєво вищу стабільність, особливий механізм ініціації трансляції й інші особливості життєвого циклу еукаріотичної мРНК.
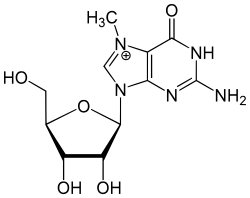
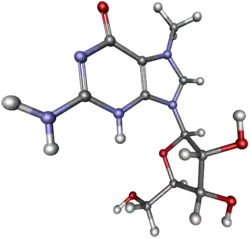
Кеп є модифікованим рибонуклеотидом — 7-метилгуанозином, сполученим 5',5'-трифосфатним містком із першим нуклеотидним залишком транскрипту. У вузькому значенні кепом називають саме 7-метилгуанозин. Окрім цього, перші два нуклеотиди транскрипту можуть бути метильованими за 2'-O-положенням залишку рибози. Кеп сприяє ефективному процесингу пре-мРНК, експорту мРНК з ядра, її трансляції та захистові від швидкої деградації.
Історія
До 1970-х років біохімічні дослідження мРНК відбувались здебільшого на кишковій паличці (Escherichia coli) та бактеріофагах. До того часу було встановлено, що мРНК кишкової палички має три фосфатні групи на 5'-кінці, таке ж припущення робилось і стосовно еукаріотичних мРНК. У 1971—1972 роках Кін-Ічіно Міура й Аарон Шаткін встановили, що РНК реовірусу містить 2'-O-метилгуанозинфосфат. Це було першим свідченням присутності нуклеотидів із метильними групами в РНК вірусів еукаріотів.
Міура продовжив роботу в Японії разом із Ясухіро Фуруіті. Останній встановив, що для ефективної транскрипції генів бакуловірусу необхідною є присутність у реакційній суміші донора метильних груп (S-аденозилметіоніну), при цьому одна метильна група входить до складу першого нуклеотиду транскрипту, а друга — до складу невідомого компонента. Також Фуруіті зазначив, що 5'-кінець таких РНК є захищеним від дії лужної фосфатази. Того ж року було опубліковано ще декілька статей, де описувалась присутність метильованих нуклеотидів у РНК, виділених із еукаріотичних клітин. Після обговорення всіх отриманих результатів Фріц Роттман припустив, що m7GppNp (де N — будь-який нуклеотид) є структурою, що блокує 5'-кінці всіх еукаріотичних мРНК. Дещо пізніше Фуруіті та Міура уточнили цю структуру та показали наявність у ній не ди-, а три-фосфатного містка. У той же ж час Вей, Мос і група Міури виявили m7GpppGp і m7GpppAp на 5'-кінцях мРНК вакциновірусу.
Незабаром Фуруіті, Шаткін і Джеймс Дарнел із колегами проаналізували мРНК клітин HeLa та виявили, що їх 5'-кінці захищені такою ж структурою, як і вірусні РНК. Дарнел уперше запропонував використовувати термін «кеп».
Особливий кеп (m2,2,7GpppNp), характерний для малих ядерних РНК, був уперше виявлений групою Гарріса Буша. Однак, як і у випадку зі звичайним кепом, першого разу структуру визначили неправильно: вона містила дифосфатний місток замість трифосфатного.
Ферменти кепування вперше виділили в лабораторії Мосса.
Типи кеп-структури та їх поширеність
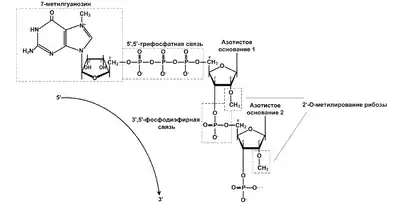
У більшості еукаріотів 5'-кінець транскриптів, що синтезуються РНК-полімеразою II, під час транскрипції модифікуються шляхом приєднання 7-метилгуанозину (див. рисунок). РНК-полімераза II синтезує всі пре-мРНК, деякі малі ядерні РНК та деякі малі ядерцеві РНК. Віруси, що пристосовані до життя в еукаріотичних клітинах, також можуть мати кеповані РНК незалежно від того, чи синтезуються вони РНК-полімеразою II, чи іншим ферментом. Залежно від систематичного положення еукаріотичного організму та типу РНК первісна кепувальна структура може підлягати подальшим модифікаціям, зокрема, метилюванню.
Станом на 2013 рік відомо такі типи кепу:
- кеп 0 (m7GpppNp, де N — будь-який нуклеотид) — це мінімальна кепувальна структура, яка складається з 7-метилгуанозину, сполученого 5',5'-трифосфатним містком із першим нуклеотидом РНК. Кеп 0 розпізнається фактором ініцації трансляції eIF4E. Кеп 0 характерний для РНК рослин (а також вірусів рослин) і грибів, у тварин спостерігається рідко (наприклад, кеп 0 виявлено разом із кепом 1 і 2 в Дрозофіли чорночеревої);
- кеп 1 (m7GpppNm2'-Op) відрізняється від кепу 0 метилюванням першого нуклеотиду транскрипту за 2'-положенням рибози;
- кеп 2 (m7GpppNm2'-OpNm2'-Op) відрізняється від кепу 0 метилюванням першого та другого нуклеотидів транскрипту за 2'-O-положенням рибози. Для РНК тварин характерні кеп 1 і кеп 2, співвідношення яких у клітині залежить від виду організму. мРНК у деяких випадках, геномні РНК вірусів тварин містять кеп 1 або кеп 2;
- кеп 4 (m7GpppNm2'-OpNm2'-OpNm2'-OpNm2'-Op) виявлений у деяких найпростіших;
- 2,2,7-триметилгуанозиновий кеп (m2,2,7GpppNp) характерний для малих ядерних РНК і слугує сигналом до їх транспорту та/чи утримання в ядрі.
У РНК вірусів тварин першим нуклеотидом після 7-метилгуанозину зазвичай є пурин, який може бути додатково метильованим за атомами азотистої основи (наприклад, із утворенням N6-метиладенозину). У клітинних ж мРНК тварин першим нуклеотидом після кепу може бути будь-який із чотирьох, і він також, як правило, додатково метильований. Загалом можна сказати, що чим вище організований організм, тим більше метильних груп спостерігається на один його кеп.
Механізми приєднання і від'єднання
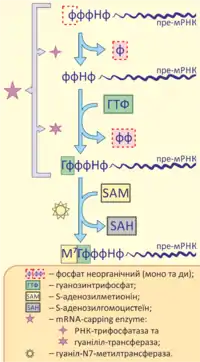
Кепування відбувається під час транскрипції. У метазоа фермент, що приєднує кеп (англ. mRNA-capping enzyme), має дві функції — він діє як РНК-трифосфатаза, так і гуаніліл-трансфераза. В результаті такої дії видаляється γ-фосфат з пре-мРНК та переноситься ГМФ з ГТФ донору. Далі гуаніл-N7-метилтрансфераза переносить метильну гурпу від донора S-аденозилметионін (SAM), що в результаті реакції перетворюється на S-аденозилгомоцистеїн (SAH)[1].
Від'єднання кепу (декепування) відбувається декількома шляхами і часто залежить від укорочення полі-А-хвосту мРНК. При РНК-інтерференції комплекс RISC та CCR4–NOT залучає РНК-геліказу DDX6, яка окрім розкручування мРНК під час трансляції може сприяти відщепленню кепа від неї.[2]
Функції
Кепування 5'-кінця РНК-транскрипту значною мірою визначає його майбутню долю в клітині. Відомі такі функції кепу:
- регуляція транскрипції;
- участь у сплайсингу;
- участь у процесингу 3'-кінця мРНК;
- регуляція транспорту РНК між ядром і цитоплазмою;
- захист транскрипту від деградації під дією екзонуклеаз;
- стимуляція трансляції.
Використання в in vitro транскрипції
Для підвищення ефективності подальшої трансляції мРНК у суміш in vitro транскрипції додають метил-гуанідин чи триметил-гуанідин. У залежності від відносної концентрації кепу та гуанозин-трифосфату термінація транскрипції може відбутися раніше за бажану.
Кепування й імунітет
Тривала коеволюція еукаріотів і їх вірусів призвела до розвитку механізмів неспецифічного розпізнавання присутності вірусів системою вродженного імунітету ссавців. Мембранні рецептори імунних клітин TLR7 і TLR8 реагують на появу в організмі одноланцюгових РНК, що містять 5'-трифосфат або кеп 0. Цитоплазматичні рецептори RIG-I і MDA5 розпізнають РНК з трифосфатом на 5'-кінці та одно- або дволанцюгові РНК з кепом 0 або білком типу VPg на 5'-кінці, відповідно. Разом з цим 2'-O-метилювання рибози в кеп-структурі постає як критерій для диференціації «своє-чуже» клітинами імунної системи. Рецептори, зв'язані зі своїми лігандами, передають сигнал іншим молекулам, що зрештою призводить до активації противірусного захисту організму. Експерименти на лабораторних мишах показали, що мутантна форма коронавірусу, не здатна до 2'-O-метилювання рибози, викликає сильнішу антивірусну відповідь і менш ефективно розмножується.
Значення для медицини
Багато патогенних мікроорганізмів і вірусів кодує власні кепувальні ферменти, й хоч синтезований ними кеп може бути ідентичним людському, ці ферменти можуть сильно відрізнятись за субодиничним складом і каталітичною активністю. На цьому заснована ідея розроблення лікарських препаратів, направлених на кепувальні ферменти патогенних мікроорганізмів. Наприклад, одним із механізмів дії противірусного препарату рибавірину, окрім інгібування РНК-реплікації, є порушення кепування вірусних мРНК. Як аналог гуанозину, рибавірин трифосфорилюється в клітині та переноситься на 5'-кінець вірусної мРНК вірусною гуанілтрансферазою. Однак вірусна гуаніл-7-метилтрансфераза неефективно метилює кеповані рибавірином РНК. Як наслідок синтезуються «псевдокеповані» мРНК, які є стабільними в клітині, але практично не транслюються у вірусні білки.
Примітки
- David L. Bentley (March 2014). Coupling mRNA processing with transcription in time and space. Nature reviews. Genetics 15 (3): 163–175. PMID 24514444. doi:10.1038/nrg3662.
- Nakanishi, Kotaro (2016). Anatomy of RISC: how do small RNAs and chaperones activate Argonaute proteins?. Wiley Interdisciplinary Reviews: RNA 7 (5): 637–660. ISSN 17577004. doi:10.1002/wrna.1356.
Джерела
- А. В. Сиволоб (2008). Молекулярна біологія. К: Видавничо-поліграфічний центр «Київський університет». с. 194.
