РНК-інтерференція
РНК-інтерференція, РНКі (англ. RNA interference, RNAi) — система контролю активності генів еукаріотичних клітин, що здійснюється за допомогою коротких (20-25 нуклеотидів) молекул рибонуклеїнової кислоти. Ключовими молекулами в РНКі є малі інтерферуючі РНК (англ. small interfering RNA, siRNA) та мікроРНК (microRNA), ці молекули можуть вступати у взаємодію із комплементарними послідовностями в інших молекулах РНК, наприклад у матричних РНК і підвищувати або пригнічувати їхню активність. Одним з найпоширеніших та найкраще вивчених механізмів дії РНКі є посттранскрипційне пригнічення експресії генів шляхом руйнування або деаденілювання мРНК.
РНК-інтерференція виявлена у клітинах більшості еукаріот (тварин, рослин, грибів). Вона є важливим механізмом захисту клітини від паразитуючих генів — вірусів та транспозонів, також бере участь у регуляції експресії власних генів організму, зокрема у процесі ембріогенезу (піРНК).
Вибірковий і потужний характер впливу РНКі на експресію генів дозволяє використовувати це явище як зручний інструмент біологічних досліджень, як у культурах клітин так і в живих організмах. Використання цього шляху також є багатообіцяючим для біотехнології та медицини, зокрема для розробки та впровадження нового покоління ліків.
Історично РНК-інтерференція була відома під іншими назвами, зокрема косупресія та посттранскрипційне пригнічення експресії генів. Тільки після детальнішого дослідження цих процесів, які спочатку здавались непов'язаними, стало зрозуміло, що всі вони є прикладами РНК-інтерференції. У 2006 році Ендрю Фаєр та Крейг Мелло отримали Нобелівську премію з фізіології та медицини за роботу, присвячену механізмам РНК-інтерференції у Caenorhabditis elegans[1], яку вони опублікували у 1998 році[2].
Історія відкриття

Відкриттю РНК-інтерференції передувало спостереження пригнічення експресії генів у рослин під впливом антисенсових РНК[4]. Пізніше вчені в Нідерландах та США отримали несподівані результати при введенні трансгену у рослини петунії. Річард Йоргенсен та співробітники намагались модифікувати рослини таким чином, щоб їхні квіти мали більш глибокий колір. Для цього вчені ввели у клітини додаткові копії гену ферменту халконсинтаза, що відповідає за утворення фіолетового пігменту. Проте, як з'ясувалось, збільшення копійності цього гену не призвело до прояву темнішого забарвлення віночка петунії, навпаки — рослини утворювали менше пігменту і квіти ставали повністю або частково білими. Ці результати свідчили про значне зниження активності халконсинтази, при чому пригнічувалась робота як трансгену, так і ендогенної копії гена цього ферменту. Це явище у рослин було назване «косупресія»[5]. Згодом аналогічнe явище було відкрите і в грибів Neurospora crassa[6]. Спочатку аналогії між цими двома випадками не було проведено, і у випадку N.crassa такий ефект називався іншим терміном — «квелінг» (англ. Quelling). Подальші дослідження показали, що косупресія у рослин зумовлена пост-траснкрипційним пригніченням експресії гену внаслідок підвищення рівня деградації мРНК[7].
Незабаром схожий несподіваний ефект був описаний при спробі підвищити стійкість рослин до вірусних інфекцій. На той час було відомо, що рослини, які експресують вірусні білки, мають нечутливість до інфікування відповідним вірусом. Несподіванкою стало те, що для отримання такої стійкості достатньо було ввести у геном рослини короткі некодуючі послідовності вірусної РНК. Припускалось, що вірусна РНК, яка утворювалась у рослинних клітинах, також пригнічувала реплікацію вірусу[8]. У зворотному експерименті короткі ділянки рослинних генів вводились у геном вірусу. В цьому випадку спостерігалось пригнічення експресії відповідного гену в рослинній клітині після її зараження модифікованим вірусом. Цей феномен отримав назву «вірус-індуковане заглушення експресії генів» (англ. virus-induced gene silencing, VIGS), а всю сукупність подібних явищ називали пост-транскрипційним заглушенням експресії генів (англ. post transcriptional gene silencing)[9]. У 1998 році у журналі Nature була опублікована робота Ендрю Фаєра та Крейґа Мело, у якій вони описували спробу заглушення експресії генів С.elegans із використанням антисенсових РНК. Ці вчені показали, що введення окремо коротких РНК, що збігалися з послідовністю мРНК цього гену або були антисенсовими до неї, у клітини нематоди, мало як мінімум у 10 разів слабший ефект на експресію гену, ніж введення суміші обох типів РНК, які утворювали дволанцюгову молекулу[2]. Таким чином було показано, що причиною виникнення пост-транскрипційного пригнічення генів є саме наявність у клітині коротких дволанцюгових молекул РНК. Результатом цих робіт було створення самого терміна «РНК-інтерференція». Фаєр та Мело отримали Нобелівську премію з фізіології та медицини у 2006 році «за відкриття РНК-інтерференції — пригнічення експресії генів дволанцюговою РНК»[1].
Молекулярні механізми
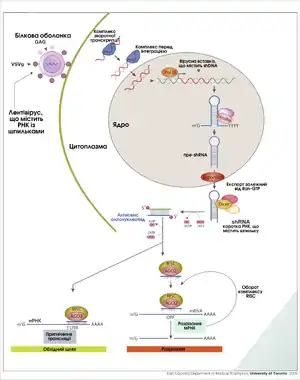
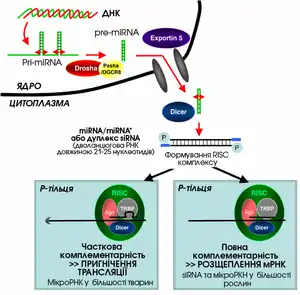
РНКі — це РНК-залежне заглушення (не плутати з пригніченням транскрипції) експресії генів, що здійснюється завдяки ефекторному білковому РНК-індукованому комплексу заглушення (англ. RNA-induced silencing complex, RISC) та ініціюється короткими дволанцюговими РНК (длРНК), які взаємодіють із цим комплексом у цитоплазмі клітини[1]. Існує два шляхи РНКі: екзогенний та ендогенний. У випадку екзогенного шляху длРНК походить із геному вірусу або є результатом лабораторних маніпуляцій. Такі длРНК у цитоплазмі ріжуться на короткі фрагменти ферментом із активністю РНКази ІІІ дайсер (англ. Dicer).
Ендогенні дволанцюгові РНК утворюються внаслідок експресії власних генів організму, наприклад генів пре-мікроРНК. Процесинг первинних транскриптів цих генів передбачає утворення характерних шпилькових структур у ядрі, які пізніше транспортуються у цитоплазму і розрізаються ферментом дайсер, внаслідок чого утворюються мікроРНК, що можуть взаємодіяти з RISC-комплексом. Таким чином шляхи екзогенних та ендогенних длРНК сходяться на рівні RISC[11].
Малі інтерферуючі РНК
Малі інтерферуючі РНК (міРНК, англ. siRNA) — це дволанцюгові РНК довжиною 21-25 нуклеотидів із двонуклеотидними виступами на 3’-кінцях. Кожен ланцюг має фосфатну групу на 5’- і гідроксильну на 3’-кінці. Така структура утворюються в результаті дії ферменту дайсер на довгі дволанцюгові РНК або РНК, що містять шпильки[12]. Після розщеплення дайсером дволанцюгові міРНК потрапляють у каталітичний RISC-комплекс. У цьому комплексі білок аргонавт (англ. Argonaute) розплітає дуплекс РНК, в результаті чого у RISC залишається тільки один із двох ланцюгів — «напрямний?». Напрямний ланцюг міРНК дозволяє ефекторному комплексу знайти специфічну мРНК-мішень, оскільки він комплементраний до певної її ділянки. Приєднання комплексу siRNA-RISC до мРНК призводить до деградації останньої. На відміну від мікроРНК, малі інтерферуючі РНК, як правило, гібридизуються із єдиним типом мРНК-мішені дуже точно і призводять до її ендонуклеотичного розщеплення[13].
МікроРНК

МікроРНК, «мір» (англ. microRNA, miRNA) — молекули РНК довжиною 21-22 нуклеотиди ендогенного походження, що беруть участь у регуляції експресії генів, зокрема у процесі індивідуального розвитку організмів[14][15]. Гени мікроРНК транскрибуються із утворенням довгих транскриптів первинної мікроРНК (англ. primordial miRNA), ці РНК процесуються у ядрі, внаслідок чого вони перетворюються у пре-мікроРНК — структури у вигляді шпильки довжиною приблизно 70 нуклеотидів. Комплекс процесингу первинного транскрипту в пре-мікроРНК містить фермент із активністю РНКази ІІІ, який називають Drosha, та білок, що зв'язує дволанцюгову РНК — Pasha. Після процесингу pre-miRNA транспортується з ядра в цитоплазму, де вона стає субстратом для ферменту дайсер (у Drosophila melanogaster та С.elegans міРНК та мікроРНК процесуються різними ізоформами ферменту дайсер[16]). Зріла молекула мікроРНК може зв'язуватись із ферментативним RISC-комплексом[17]. Відомий також шлях процесингу мікроРНК, не залежний від дайсеру. У цьому випадку пре-мікроРНК ріжеться білком-аргонавтом 2[18]. Принципова різниця між міРНК та мікроРНК полягає у тому, що у тварин послідовність мікроРНК не повністю комплементарна до послідовності мРНК-мішені, таким чином мікроРНК можуть інгібувати трансляцію із кількох різних мРНК, що містять схожі послідовності (у рослин як мікроРНК так і міРНК зазвичай повністю комплементарні до РНК-мішені). МікроРНК приєднуються до 3'-UTR (3'-кінцевої ділянки, що не транслюється) мРНК і викликають видалення полі(А)-хвоста?? або пригнічення трансляції іншим шляхом[13].
Ефекторний комплекс RISC
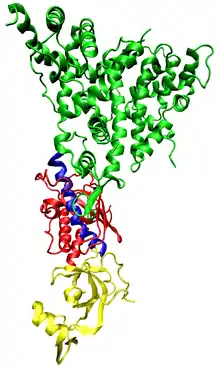
RISC (англ. RNA-induced silencing complex, РНК-індукований сайленсинг-комплекс) — ефекторний білковий комплекс, що забезпечує ендонуклеазне розщеплення мРНК у процесі РНК-інтерференції. Каталітичною частиною RISC є ендонуклеази родини аргонавтів (Argonaute), які розщеплюють мРНК, комплементарну до міРНК або мікроРНК RISC-комплексу[1].
Фрагменти, які утворюються внаслідок дії ферменту дайсер на дволанцюгову РНК, є також дволанцюговими, і, теоретично, будь-який із двох ланцюгів може входити в активний RISC-комплекс. Проте із білком-аргонавтом зв'язуються тільки один з цих ланцюгів, який називається «напрямним» (англ. guide strand), і тільки він бере участь у пошуку мРНК-мішені. Інший ланцюг — ланцюг-супутник (англ. passenger strand, anti-guide strand) розщеплюється у процесі активації RISC[19]. Раніше вважалось, що ланцюги розділяються АТФ-залежними геліказами[20]; зараз стало відомо, що даний процес є АТФ-незалежним і здійснюється безпосередньо білками, що входять до складу RISC[21][22]. За напрямний зазвичай вибирається той ланцюг, 5'- кінець якого менш міцно приєднаний до комплементарного ланцюга; на вибір не впливає напрямок, у якому розрізає длРНК дайсер[23][24]. Більш стабільний 5'-кінець ланцюга-супутника може розпізнаватись білком R2D2[25].
Рентгеноструктурний аналіз дозволив проаналізувати зв'язування молекул РНК із РНК-зв'язуючим доменом білків-аргонавтів. Було встановлено, що фосфорильований 5'-кінець одноланцюгової РНК потрапляє у позитивно заряджену кишеню білка, і через іони Mg2+ вступає у стекінг-взаємодію із консервативними залишком тирозину. Ця ділянка білка стимулює зв'язування інтерферуючих РНК із мішенню мРНК[26].
Механізм, за яким RISC знаходить комплементарну мРНК, досліджений недостатньо. Показано, що для успішної деградації мРНК комплексом мікроРНК-RISC трансляція не є необхідною[27], більше того шлях РНК-інтерференції може бути ефективнішим для мРНК-мішеней, які не транслюються в цей час[28].
Білки-аргонавти є каталітичною частиною RISC, вони локалізуються у спеціальних ділянках цитоплазми, відомих як Р-тільця (англ. Processing bodies)[29]. Р-тільця — це ділянки з високими рівнями деградації РНК; показано, що саме тут спостерігається максимальна активність мікроРНК. Руйнування Р-тілець призводить до значного зниження ефективності процесу РНК-інтерференції[30].
Пригнічення транскрипції
Крім того, що РНКі діє на рівні пригнічення трансляції, вона також може впливати і на транскрипцію генів. Багато еукаріотів використовують цей шлях для підтримання структури геному. Модифікація гістонів дозволяє зменшити експресію генів із певної ділянки, оскільки ця ділянка переходить у стан гетерохроматину. Деколи цей процес пов'язаний із РНК-інтерференцією, тоді його називають RITS (англ. RNA-induced transcriptional silencing, РНК-індуковане пригнічення транскрипції). Вивчення явища RITS в основному було обмежене дослідженням експресії ділянки, що відповідає за тип спарювання у дріжджів Schizosaccharomyces pombe, але отримані дані можуть не справджуватись для геномів інших організмів.
У дріжджів S.pombe пригнічення транскрипції забезпечує RITS-комплекс, який містить аргонавт, білок Chp1 із хромодоменом (домен, який знаходять у білків, пов'язаних із організацією і перебудовою хроматину), та білок із невідомою функцією Tas3[31]. Для індукції утворення ділянок гетерохроматину необхідний фермент дайсер, а також білок-аргонавт і РНК-залежна РНК-полімераза[32][33]. Делеція цих генів у S.pombe порушує метилювання гістонів і формування центромер[34], через що поділ клітини зупиняється або сповільнюється в анафазі[35].
Для підтримання вже сформованих ділянок гетерохроматину RITS формує комплекс із міРНК, комплементарними до генів у даній ділянці, і стабільно зв'язується із метильованими гістонами. Цей комплекс забезпечує котранскрипційну деградацію будь-яких пре-мРНК, синтез яких ініціює РНК-полімераза. Вважається, що ділянки гетерохроматину підтримуються на основі позитивного зворотного зв'язку, через те що нові міРНК формуються РНК-залежною РНК-полімеразою із випадкових транскриптів і включаються в комплекс RITS[36]. Всі описані дані були отримані тільки для S.pombe, у ссавців підтримання ділянок гетерохроматину може бути РНКі-незалежним[37].
Зв'язок із редагуванням РНК
Найбільш розповсюдженою формою редагування РНК у вищих еукаріот є перетворення аденозину в інозин у дволанцюгових РНК, яке здійснюється ферментом аденозиндеаміназою[38]. У 2000 році було припущено, що шлях РНК-інтерференції і шлях редагування РНК A→I можуть конкурувати за спільний субстрат — дволанцюгову РНК[39]. Справді, деякі пре-мікроРНК можуть підлягати редагуванню A→I[40][41], причому цей механізм може регулювати процесинг та експресію зрілих молекул мікроРНК[41]. У ссавців описаний як мінімумум один фермент РНК-редагування, що може вивести молекули міРНК із системи РНКі[42]. Дослідження лінії C.elegans, що не має генів редагування A→I, показали, що редагування РНК може запобігати пригніченню експресії ендогенних генів і трансгенів по шляху РНКі[43].
Відмінності між організмами
Організми відрізняються між собою по здатності сприймати чужорідні дволанцюгові РНК і використовувати їх у процесі РНК-інтерференції. У рослин та C.elegans (але не в дрозофіли та ссавців) ефект РНК-інтерференції може бути системним: введення навіть невеликої кількості длРНК у клітини викликає пригнічення експресії відповідного гену у всьому організмі, у C.elegans ефект РНКі може навіть успадковуватись. Для системної дії РНКі сигнал повинен ампліфікуватись та передаватись між клітинами. В ампліфікації сигналу бере участь РНК-залежна РНК-полімераза; вважається, що міРНК може виступати праймером для синтезу наступних молекул дволанцюгової РНК, що стане субстратом для ферменту дайсер[45]. Транспорт siRNA у рослин може відбуватись по плазмодесмах[20]. Успадкування ефектів РНКі у рослин може бути незалежним від самих РНК, а забезпечуватись метилюванням промоторів відповідних генів, змінений характер метилювання передається кожній із дочірніх клітин при поділі[46] .
Основні відмінності у механізмі РНКі в тварин та рослин полягають у тому, що в рослин ендогенні мікроРНК ідеально комплементарні до мРНК мішені і в комплексі з RISC викликають деградацію цієї РНК. У тварин мікроРНК не повністю комплементарні до гену-мішені і викликають пригнічення трансляції[44], наприклад шляхом запобігання взаємодії факторів ініціації трансляції та полі-(А)-хвоста мРНК[47].
У деяких еукаріот, наприклад, паразитичних одноклітинних Leishmania major та Trypanosoma cruzi всі компоненти РНКі відсутні[48][49]. Велика частина компонентів системи РНК-інтерференції також відсутня і у деяких грибів, наприклад у пивних дріжджів Saccharomyces cerevisiae[50]. В інших дріжджів, що розмножуються брунькуванням, наприклад у Saccharomyces castellii та Candida albicans присутні всі компоненти РНК-інтерференції. Перенесення двох білків системи РНКі із S.castellii у клітини S.cerevisiae робить можливою РНК-інтерференцію в останніх[51] . Той факт, що деякі аскоміцети та базидіоміцети не мають шляху РНК-інтерференції вказує на те, що гени, які кодують білки необхідні для даного процесу, були втрачені незалежно у багатьох філогенетичних гілках грибів, ймовірно, через еволюцію нового шляху зі схожими функціями, або через втрату адаптивної переваги в даних екологічних нішах[52].
Аналог РНКі у прокаріот
У прокаріот експресія генів залежить від РНК-залежної системи, схожої до РНКі: РНК-кодуючі гени контролюють кількість мРНК та трансляцію через утворення комплементарних РНК, що приєднуються до мРНК. Проте ці регуляторні РНК не вважаються гомологічними до мікроРНК, оскільки фермент дайсер не задіяний в їх утворенні[53]. Також припускається, що система інтерференції CRISPR (англ. Clustered Regularly Interspaced Short Palindromic Repeats, короткі паліндромні повтори, регулярно розміщені групами), яка забезпечує бактеріям захист від бактеріофагів, є аналогом еукаріотичної системи РНК-інтерференції. Проте жоден із білкових компонентів цих двох систем не є гомологічними[54].
Біологічні функції
Імунітет
Система РНК-інтерференції — важлива частина імунної відповіді на віруси та інший генетично чужорідний матеріал, особливо у рослин, в яких вона також обмежує розповсюдження транспозонів[55]. Рослини (наприклад A.thaliana) мають кілька гомологів білка дайсер, які використовуються проти різних типів вірусів[56]. У рослин РНКі, що виникає у відповідь на зараження вірусом, має системний характер — тобто може розповсюджуватись по всьому тілу рослини, і навіть передаватись від підщепи до прищепи[57]. Отже РНКі є механізмом набутого противірусного імунітету у рослин. У відповідь у ході еволюції багато вірусів розвинули механізми пригнічення РНК-інтерференції у клітинах рослин[58]. Описано вірусні білки, що можуть зв'язувати короткі дволанцюгові РНК із двонуклеотидними виступами на кінцях, які є продуктами ферменту дайсер[59]. Деякі рослини після зараження певними бактеріями починають експресувати ендогенні міРНК[60]. Така реакція може бути частиною генералізованої відповіді організму на патогени, що здійснюється шляхом пригінчення багатьох метаболічних процесів[61].
Хоча в клітинах тварин, як правило, експресується менше варіантів білка дайсер, ніж у рослин, система РНКі може брати участь в антивірусній відповіді і в них. РНКі відіграє важливу роль у вродженому противірусному імунітеті, зокрема захищає від Х-вірусу дрозофіли ювенільні і дорослі особини D.melanogaster[62][63]. Подібну роль в імунітеті система РНКі відіграє у C.elegans: експресія білків-аргонавтів підвищується при вірусній інфекції, при цьому нематоди отримують стійкість до вірусних інфекцій[64][65].
Роль РНКі у вродженому імунітеті ссавців не повністю досліджена. Однак той факт, що деякі віруси ссавців містять гени, які можуть пригнічувати цю систему в клітинах хазяїна, свідчить про те, що РНКі може бути частиною противірусного імунітету ссавців[66][67] . Проте ця гіпотеза поки не має достатнього підґрунтя і потребує подальших досліджень[68]. Віруси ссавців можуть використовувати РНК-інтерференцію і в інших цілях, наприклад малі інтерферуючі РНК, що експресуються вірусом герпесу, можуть викликати утворення гетерохроматину, що призводить до переходу вірусу в латентний стан[69].
Пригнічення експресії генів
МікроРНК у геномі більшості еукаріот відіграють важливу роль у заглушенні експресії інших генів[44] та у регуляції розвитку, особливо у визначенні часу морфогенезу та підтриманні недиференційованих або не повністю диференційованих типів клітин, таких як стовбурові клітини[70]. Роль ендогенних мікроРНК у заглушенні експресії генів була вперше описана у C. elegans у 1993 році[71]. У рослин таку функцію виявили, коли було показано, що «JAW мікроРНК» A.thaliana задіяна у регуляції кількох генів, що визначають форму рослини[72]. У рослин більшість генів, на експресію яких впливають мікроРНК, — це гени транскрипційних факторів[73], таким чином розмах активності РНКі дуже широкий, вона регулює цілі сітки генів під час ембріогенезу і впливає на експресію головних регуляторних генів, включаючи фактори траснкрипції та білки F-box[74]. У багатьох організмів, в тому числі і в людей, мікроРНК також можуть бути пов'язані із формуванням пухлин та пригніченням клітинного циклу. В цьому випадку окремі мікроРНК можуть діяти і як онкогени, і як супресори пухлинного росту[75].
Еволюція
Методи обчислювального філогенетичного аналізу показують, що найближчий спільний предок усіх еукаріотичних організмів мав ранній шлях РНКі. Відсутність цього шляху в деяких еукаріот є ознакою, набутою пізніше у процесі еволюції[78]. Предкова система РНКі містила принаймні один дайсер-подібний білок, один аргонавт, один білок PIWI та РНК-залежну РНК-полімеразу, яка могла брати участь і в інших клітинних процесах. Первинною функцією РНКі був імунний захист від екзогенних генетичних елементів, таких як вірусні геноми та транспозони[78][79]; інші функції, такі як модифікація гістонів також могли бути присутніми у предкових форм. Однак брати участь у менш споріднених процесах, зокрема регуляції ембріогенезу, мікроРНК стали пізніше в процесі еволюції[78]. Гени РНК-інтерференції, як частина вродженої імунної системи багатьох еукаріот, постійно змінюються внаслідок еволюційної гонки озброєнь. Деякі віруси «навчились» пригнічувати РНКі у клітинах живителя, зокрема багато вірусів рослин[58]. Дослідження швидкості еволюції у дрозофіли показали, що на гени шляху РНКі діє сильний рушійний добір. Швидкість еволюції цих генів є одною із найвищих у геномі дрозофіли[80].
Прикладне застосування
Нокдаун генів
Шлях РНК-інтерференції часто використовується в біології для вивчення функцій окремих генів, як у культурах клітин, так і in vivo[1]. Дволанцюгова РНК, один із ланцюгів якої комплементарний до досліджуваного гену, вводиться у клітину або організм, де вона розпізнається як чужорідна і активує РНК-інтерференцію. Використовуючи цей механізм, вчені можуть дуже сильно знизити експресію гена-мішені. Вивчення впливу «вимикання» відповідного гену на організм чи клітину дає можливість робити висновки про фізіологічну роль продукту даного гену. Оскільки РНКі не повністю усуває експресію гена, а тільки дуже суттєво її знижує, така методика називається «нокдауном» гену, на противагу до «нокауту» гену, за якого ген повністю видаляється[81] .
Зусилля біоінформатики спрямовані на те, щоб розробити цільові дволанцюгові РНК, які будуть мати максимальний вплив на ген-мішень і мінімальні побічні ефекти. Побічні ефекти виникають, коли введена в клітину РНК має спільні нуклеотидні послідовності з кількома генами і впливає на них всі. Дослідження геномів H. sapiens, C. elegans та Schizosaccharomyces pombe показали, що близько 10 % можливих siRNA будуть діяти на гени, відмінні від своєї мішені[82]. Розроблена велика кількість програмного забезпечення для підбору послідовностей міРНК[83][84], в тому числі специфічних для ссавців[85] і вірусів[86]. Ці програми автоматично перевіряють можливість перехресного реагування із послідовностями інших генів.
Залежно від виду організму та експериментальної системи, екзогенні РНК можуть бути або довгими, у такому разі вона має стати субстратом для розщеплення дайсером, або короткими фрагментами, що є вже готовими молекулами міРНК. Для більшості клітин ссавців використовують короткі РНК, оскільки довгі дволанцюгові РНК можуть запускати інтерферонову відповідь — форму вродженого імунітету, яка неспецифічно реагує на будь-який чужорідний генетичний матеріал[87]. У миші в яйцеклітинах та клітинах ембріонів ранніх стадій така реакція на чужорідну длРНК відсутня, тому ці клітини є поширеними моделями для вивчення ефектів нокдауну генів у ссавців[88]. Розробляються спеціальні лабораторні методи, що дозволяють покращити використання РНКі у ссавців, уникаючи прямого введення міРНК. Одним із таких методів є стабільна трансфекція клітин плазмідою, що містить послідовність, з якої можуть зчитуватись міРНК[89]. Складніша процедура, в якій використовуються лентівірусні вектори, передбачає можливість індукованої активації або деактивації транскрипції, і відома під назвою умовна РНКі (англ. conditional RNAi)[90][91].
Функціональна геноміка
.jpg.webp)

Методи функціональної геноміки, що використовують РНКі, зазвичай застосовують для C. elegans[93] та дрозофіли[94], через те що у цих модельних організмів РНКі найбільш ефективна. C. elegans — особливо зручний об'єкт з двох причин: по-перше, ефекти пригнічення експресії генів у неї успадковуються, по-друге — доставка длРНК надзвичайно проста. Хоча механізм цього явища не цілком зрозумілий, при згодовуванні бактерій, наприклад E.coli, які експресують потрібну РНК, нематоді, РНК проходить через травну систему у клітини C. elegans. Така «доставка годуванням» настільки ж ефективна, як і інші, дорожчі методи, наприклад занурення нематоди у розчин длРНК або введення останньої у гонади[95]. Хоча в інших організмів доставка значно складніша, прикладається багато зусиль щодо використання методів РНКі у широкомасштабному геномному скрінінгу в культурах клітин ссавців[96].
Підходи до створення бібліотек РНКі для цілих геномів організмів значно складніші, ніж створення однієї міРНК для конкретного експерименту. Для створення таких бібліотек міРНК передбачення ефективності їх дії використовуються штучні нейронні системи[97]. Масовий геномний скрінінг вважається багатообіцяючим методом тлумачення геномів, тому розвиваються високопродуктивні методи скрінінгу, базовані на технології ДНК-мікрочипів[98][99]. Проте, під питанням залишається те, чи можна поширювати отримані дані навіть на близькі види, наприклад дані про C.elegans на паразитичні види нематод[100][101] Функціональна геноміка, що використовує РНКі, є особливо привабливою методикою для картування та тлумачення геномів рослин, тому що багато із них поліплоїдні, що ускладнює використання стандартних методів генетичної інженерії. Наприклад, РНКі успішно використовується для дослідження геному пшениці м'якої Triticum aestivum (гексаплоїд)[102], а також класичних об'єктів, таких як Arabidopsis та кукурудза[103].
Медицина
Клітинний шлях РНК-інтерференції потенційно можна використовувати для лікування багатьох захворювань, в тому числі СНІДу, злоякісних новоутворень та нейродегенеративних розладів. Хоча введення довгих длРНК у клітини ссавців проблематичне через інтерферонову відповідь, короткі РНК, що копіюють дію міРНК, дають бажаний ефект[104]. Були проведені перші клінічні дослідження методу РНКі для лікування дегенерації жовтої плями сітківки та зараження респіраторним синцитіальним вірусом[105]. Також ця методика успішно використовувалась для терапії пошкодження печінки у лабораторних мишей[106].
Потенційно РНКі може використовуватись в антивірусній терапії для лікування інфекції вірусом герпесу 2-го типу, пригнічення експресії вірусних генів у пухлинних клітинах[107], нокдауну рецепторів та корецепторів до ВІЛ[108], для супресії генів вірусів гепатитів А[109] та В[110], вірусу грипу[69], інгібування реплікації вірусу кору[111]. Також методики, що базуються на РНКі, є багатообіцяючими для терапії нейродегенеративних захворювань, таких як хвороба Гантінгтона[112]. Досліджується можливість використання РНКі для лікування раку, шляхом пригнічення експресії генів, активність яких селективно збільшена у пухлинних клітинах, та генів, задіяних у регуляції клітинного циклу[113][114]. Ключовим питанням у дослідженнях медичного використання РНКі є розробка безпечних методів доставки длРНК. Зараз для цього використовується багато вірусних векторів, схожих на ті, що запропоновані до використання у генній терапії[115][116]. Розробляються також методики, базовані на РНКі для лікування персистентної інфекції ВІЛ першого типу. Віруси, схожі на ВІЛ-1, особливо проблематичні у терапії, оскільки потребують комбінації кількох шляхів РНКі[117].
Незважаючи на стрімкий ріст кількості досліджень, у яких ліки на основі РНК-інтерференції успішно використовуються в культурах клітин, постають також і питання стосовно безпечності використання таких методів лікування, особливо зважаючи на можливість побічних ефектів — супресію генів, що мають схожі послідовності до гену-мішені[118]. За допомогою методів обчислювальної геноміки було встановлено, що імовірність такої неспецифічної дії становить близько 10 %[82]. Масштабне дослідження захворювань печінки мишей показало високий рівень смертності серед піддослідних тварин при лікуванні РНКі. Вчені пояснюють такі результати «перенасиченням» шляху длРНК[119], через те що використовуються РНК із шпильками, що процесуються в ядрі і повинні переноситись у цитоплазму по механізму активного транспорту. Всі ці аспекти зараз активно досліджуються, щоб встановити наскільки безпечним є використання даної методики у терапії. Отже, РНК-інтерференція є багатообіцяючим інструментом у лікуванні багатьох захворювань, проте дуже важливо проводити ретельні пре-клінічні дослідження та оцінку імовірності неспецифічних взаємодій.
Перший препарат на основі малих інтерференційних олігонуклеотидів, патісіран був дозволений FDA США в серпні 2018 року та спрямований на лікування поліневриту, що виникає в результаті рідкісного спадкового захворювання — спадкової амілоїдної полінейропатії. Олігонуклеотиди призводять до пригнічення синтезу ненормального мутованого білка транстиретину.[120]
Біотехнологія
РНК-інтерференція використовується у біотехнології, зокрема для створення їстівних рослин із меншим вмістом природних токсинів. Наприклад, насіння бавовни містить багато поживного білка, але до його складу входить також і токсичний терпеноїд госипол, через що це насіння непридатне для споживання. Використання РНКі дозволило створити сорти бавовни із зменшеною активністю ферменту, що синтезує госипол, у насінні, але не в інших частинах рослини, де ця речовина необхідна для захисту рослини від шкідників[121]. Були здійснені схожі спроби скоротити кількість ціаногенного глікозиду лінамарину у рослинах маніоки (Manihot utilissima)[122].
Хоча жоден із сортів рослин, створених за допомогою техніки, базованої на РНКі, не пройшов поки що експериментальної стадії, ці методи і далі стрімко розвиваються: розроблені сорти помідорів із зниженою кількістю алергенів[123], тютюн із зменшеним вмістом попередників канцерогенних речовин[124]. Методики РНКі також використовувались і для створення маку Papaver somniferum, що міститиме менше опійних алкалоїдів[125], підвищення стійкості рослин до вірусних інфекцій[126], підвищення вмісту антикосидантів у томатах[127] . Перші трансгенні рослини — помідори Flavr Sarv і стійка до вірусів папая — були створені із використанням методики антисенсових РНК, яка, швидше за все, діє по шляху РНК-інтерференції[128][129].
Джерела
- Daneholt, Bertil. Advanced Information: RNA interference. The Nobel Prize in Physiology or Medicine 2006. Архів оригіналу за 25 серпня 2011. Процитовано 25 січня 2007.
- Fire A, Xu S, Montgomery M, Kostas S, Driver S, Mello C (1998). Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391 (6669): 806–11. PMID 9486653. doi:10.1038/35888.
- Matzke MA, Matzke AJM. (2004). Planting the Seeds of a New Paradigm.. PLoS Biol 2 (5): e133. PMID 15138502. doi:10.1371/journal.pbio.0020133.
- Ecker JR, Davis RW (1986). Inhibition of gene expression in plant cells by expression of antisense RNA. Proc Natl Acad Sci USA 83 (15): 5372–5376. PMC 386288. PMID 16593734. doi:10.1073/pnas.83.15.5372.
- Napoli C, Lemieux C, Jorgensen R (1990). Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans. Plant Cell 2 (4): 279–289. PMC 159885. PMID 12354959. doi:10.1105/tpc.2.4.279.
- Romano N, Macino G (1992). Quelling: transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences. Mol Microbiol 6 (22): 3343–53. PMID 1484489. doi:10.1111/j.1365-2958.1992.tb02202.x.
- Van Blokland R, Van der Geest N, Mol JNM, Kooter JM (1994). Transgene-mediated suppression of chalcone synthase expression in Petunia hybrida results from an increase in RNA turnover. Plant J 6: 861–77. doi:10.1046/j.1365-313X.1994.6060861.x/abs/.[недоступне посилання з 01.10.2019]
- Covey S, Al-Kaff N, Lángara A, Turner D (1997). Plants combat infection by gene silencing. Nature 385 (6619): 781–2. doi:10.1038/385781a0.
- Ratcliff F, Harrison B, Baulcombe D (1997). A Similarity Between Viral Defense and Gene Silencing in Plants. Science 276 (5318): 1558–60. PMID 18610513. doi:10.1126/science.276.5318.1558.
- Macrae I, Zhou K, Li F, Repic A, Brooks A, Cande W, Adams P, Doudna J (2006). Structural basis for double-stranded RNA processing by dicer. Science 311 (5758): 195–8. PMID 16410517. doi:10.1126/science.1121638.
- Bagasra O, Prilliman KR (2004). RNA interference: the molecular immune system. J. Mol. Histol. 35 (6): 545–53. PMID 15614608. doi:10.1007/s10735-004-2192-8.
- Bernstein E, Caudy A, Hammond S, Hannon G (2001). Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature 409 (6818): 363–6. PMID 11201747. doi:10.1038/35053110.
- Pillai RS, Bhattacharyya SN, Filipowicz W (2007). Repression of protein synthesis by miRNAs: how many mechanisms?. Trends Cell Biol 17 (3): 118–26. PMID 17197185. doi:10.1016/j.tcb.2006.12.007.
- Wang QL, Li ZH (2007). The functions of microRNAs in plants. Front. Biosci. 12: 3975–82. PMID 17485351.
- Zhao Y, Srivastava D (2007). A developmental view of microRNA function. Trends Biochem. Sci. 32 (4): 189–97. PMID 17350266. doi:10.1016/j.tibs.2007.02.006.
- Lee Y, Nakahara K, Pham J, Kim K, He Z, Sontheimer E, Carthew R (2004). Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways. Cell 117 (1): 69–81. PMID 15066283. doi:10.1016/S0092-8674(04)00261-2.
- Gregory R, Chendrimada T, Shiekhattar R (2006). MicroRNA biogenesis: isolation and characterization of the microprocessor complex. Methods Mol Biol 342: 33–47. PMID 16957365. doi:10.1385/1-59745-123-1:33.
- Cheloufi S, Dos Santos CO, Chong MM, Hannon GJ. A dicer-independent miRNA biogenesis pathway that requires Ago catalysis // Nature. — 2010. — Вип. doi:10.1038/nature09092. — С. Published Online April 27, 2010.
- Gregory R, Chendrimada T, Cooch N, Shiekhattar R (2005). Human RISC couples microRNA biogenesis and posttranscriptional gene silencing. Cell 123 (4): 631–40. PMID 16271387. doi:10.1016/j.cell.2005.10.022.
- Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipurksy SL, Darnell J (2004). Molecular Cell Biology (вид. 5th). WH Freeman: New York, NY. ISBN 978-0716743668.
- Matranga C, Tomari Y, Shin C, Bartel D, Zamore P (2005). Passenger-strand cleavage facilitates assembly of siRNA into Ago2-containing RNAi enzyme complexes. Cell 123 (4): 607–20. PMID 16271386. doi:10.1016/j.cell.2005.08.044.
- Leuschner P, Ameres S, Kueng S, Martinez J (2006). Cleavage of the siRNA passenger strand during RISC assembly in human cells. EMBO Rep 7 (3): 314–20. PMC 1456892. PMID 16439995. doi:10.1038/sj.embor.7400637.
- Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, Zamore PD (2003). Asymmetry in the assembly of the RNAi enzyme complex. Cell 115 (2): 199–208. PMID 14567917. doi:10.1016/S0092-8674(03)00759-1.
- Preall J, He Z, Gorra J, Sontheimer E (2006). Short interfering RNA strand selection is independent of dsRNA processing polarity during RNAi in Drosophila. Curr Biol 16 (5): 530–5. PMID 16527750. doi:10.1016/j.cub.2006.01.061.
- Tomari Y, Matranga C, Haley B, Martinez N, Zamore P (2004). A protein sensor for siRNA asymmetry. Science 306 (5700): 1377–80. PMID 15550672. doi:10.1126/science.1102755.
- Ma J, Yuan Y, Meister G, Pei Y, Tuschl T, Patel D (2005). Structural basis for 5'-end-specific recognition of guide RNA by the A. fulgidus Piwi protein. Nature 434 (7033): 666–70. PMID 15800629. doi:10.1038/nature03514.
- Sen G, Wehrman T, Blau H (2005). mRNA translation is not a prerequisite for small interfering RNA-mediated mRNA cleavage. Differentiation 73 (6): 287–93. PMID 16138829. doi:10.1111/j.1432-0436.2005.00029.x.
- Gu S, Rossi J (2005). Uncoupling of RNAi from active translation in mammalian cells. RNA 11 (1): 38–44. PMC 1370689. PMID 15574516. doi:10.1261/rna.7158605.
- Sen G, Blau H (2005). Argonaute 2/RISC resides in sites of mammalian mRNA decay known as cytoplasmic bodies. Nat Cell Biol 7 (6): 633–6. PMID 15908945. doi:10.1038/ncb1265.
- Jakymiw A, Lian S, Eystathioy T, Li S, Satoh M, Hamel J, Fritzler M, Chan E (2005). Disruption of P bodies impairs mammalian RNA interference. Nat Cell Biol 7 (12): 1267–74. PMID 16284622. doi:10.1038/ncb1334.
- Verdel A, Jia S, Gerber S, Sugiyama T, Gygi S, Grewal S, Moazed D (2004). RNAi-mediated targeting of heterochromatin by the RITS complex. Science 303 (5658): 672–6. PMID 14704433. doi:10.1126/science.1093686.
- Irvine D, Zaratiegui M, Tolia N, Goto D, Chitwood D, Vaughn M, Joshua-Tor L, Martienssen R (2006). Argonaute slicing is required for heterochromatic silencing and spreading. Science 313 (5790): 1134–7. PMID 16931764. doi:10.1126/science.1128813.
- Noma K, Sugiyama T, Cam H, Verdel A, Zofall M, Jia S, Moazed D, Grewal S (2004). RITS acts in cis to promote RNA interference-mediated transcriptional and post-transcriptional silencing. Nat Genet 36 (11): 1174–80. PMID 15475954. doi:10.1038/ng1452.
- Volpe T, Kidner C, Hall I, Teng G, Grewal S, Martienssen R (2002). Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi. Science 297 (5588): 1833–7. PMID 12193640. doi:10.1126/science.1074973.
- Volpe T, Schramke V, Hamilton G, White S, Teng G, Martienssen R, Allshire R (2003). RNA interference is required for normal centromere function in fission yeast. Chromosome Res 11 (2): 137–46. PMID 12733640. doi:10.1023/A:1022815931524.
- Sugiyama T, Cam H, Verdel A, Moazed D, Grewal S (2005). RNA-dependent RNA polymerase is an essential component of a self-enforcing loop coupling heterochromatin assembly to siRNA production. Proc Natl Acad Sci USA 102 (1): 152–7. PMC 544066. PMID 15615848. doi:10.1073/pnas.0407641102.
- Wang F, Koyama N, Nishida H, Haraguchi T, Reith W, Tsukamoto T (2006). The assembly and maintenance of heterochromatin initiated by transgene repeats are independent of the RNA interference pathway in mammalian cells. Mol Cell Biol 26 (11): 4028–40. PMC 1489094. PMID 16705157. doi:10.1128/MCB.02189-05.
- Bass B (2002). RNA editing by adenosine deaminases that act on RNA. Annu Rev Biochem 71: 817–46. PMC 1823043. PMID 12045112. doi:10.1146/annurev.biochem.71.110601.135501.
- Bass B (2000). Double-stranded RNA as a template for gene silencing. Cell 101 (3): 235–8. PMID 10847677. doi:10.1016/S0092-8674(02)71133-1.
- Luciano D, Mirsky H, Vendetti N, Maas S (2004). RNA editing of a miRNA precursor. RNA 10 (8): 1174–7. PMC 1370607. PMID 15272117. doi:10.1261/rna.7350304.
- Yang W, Chendrimada T, Wang Q, Higuchi M, Seeburg P, Shiekhattar R, Nishikura K (2006). Modulation of microRNA processing and expression through RNA editing by ADAR deaminases. Nat Struct Mol Biol 13 (1): 13–21. PMC 2950615. PMID 16369484. doi:10.1038/nsmb1041.
- Yang W, Wang Q, Howell K, Lee J, Cho D, Murray J, Nishikura K (2005). ADAR1 RNA deaminase limits short interfering RNA efficacy in mammalian cells. J Biol Chem 280 (5): 3946–53. PMC 2947832. PMID 15556947. doi:10.1074/jbc.M407876200.
- Nishikura K (2006). Editor meets silencer: crosstalk between RNA editing and RNA interference. Nat Rev Mol Cell Biol 7 (12): 919–31. PMC 2953463. PMID 17139332. doi:10.1038/nrm2061.
- Saumet A, Lecellier CH (2006). Anti-viral RNA silencing: do we look like plants?. Retrovirology 3 (3): 3. PMC 1363733. PMID 16409629. doi:10.1186/1742-4690-3-3.
- Hannon GL (2002). RNA interference. Nature 418: 244–51. PMID 12110901.
- Jones L, Ratcliff F, Baulcombe DC (2001). RNA-directed transcriptional gene silencing in plants can be inherited independently of the RNA trigger and requires Met1 for maintenance. Current Biology 11 (10): 747–757. PMID 11378384. doi:10.1016/S0960-9822(01)00226-3.
- Humphreys DT, Westman BJ, Martin DI, Preiss T (2005). MicroRNAs control translation initiation by inhibiting eukaryotic initiation factor 4E/cap and poly(A) tail function.. Proc Natl Acad Sci USA 102 (47): 16961–16966. PMC 1287990. PMID 16287976. doi:10.1073/pnas.0506482102.
- DaRocha W, Otsu K, Teixeira S, Donelson J (2004). Tests of cytoplasmic RNA interference (RNAi) and construction of a tetracycline-inducible T7 promoter system in Trypanosoma cruzi. Mol Biochem Parasitol 133 (2): 175–86. PMID 14698430. doi:10.1016/j.molbiopara.2003.10.005.
- Robinson K, Beverley S (2003). Improvements in transfection efficiency and tests of RNA interference (RNAi) approaches in the protozoan parasite Leishmania. Mol Biochem Parasitol 128 (2): 217–28. PMID 12742588. doi:10.1016/S0166-6851(03)00079-3.
- L. Aravind, Hidemi Watanabe, David J. Lipman, and Eugene V. Koonin (2000). Lineage-specific loss and divergence of functionally linked genes in eukaryotes. Proceedings of the National Academy of Sciences 97 (21): 11319–11324. PMC 17198. PMID 11016957. doi:10.1073/pnas.200346997.
- Drinnenberg IA, Weinberg DE, Xie KT, Nower JP, Wolfe KH, Fink GR, Bartel DP (2009). RNAi in Budding Yeast. Science 326 (5952): 544–50. PMID 19745116. doi:10.1126/science.1176945.
- Nakayashiki H, Kadotani N, Mayama S (2006). Evolution and diversification of RNA silencing proteins in fungi. J Mol Evol 63 (1): 127–35. PMID 16786437. doi:10.1007/s00239-005-0257-2.
- Morita T, Mochizuki Y, Aiba H (2006). Translational repression is sufficient for gene silencing by bacterial small noncoding RNAs in the absence of mRNA destruction. Proc Natl Acad Sci USA 103 (13): 4858–63. PMC 1458760. PMID 16549791. doi:10.1073/pnas.0509638103.
- Makarova K, Grishin N, Shabalina S, Wolf Y, Koonin E (2006). A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biol Direct 1: 7. PMC 1462988. PMID 16545108. doi:10.1186/1745-6150-1-7.
- Stram Y, Kuzntzova L (2006). Inhibition of viruses by RNA interference. Virus Genes 32 (3): 299–306. PMID 16732482. doi:10.1007/s11262-005-6914-0.
- Blevins T, Rajeswaran R, Shivaprasad P, Beknazariants D, Si-Ammour A, Park H, Vazquez F, Robertson D, Meins F, Hohn T, Pooggin M (2006). Four plant Dicers mediate viral small RNA biogenesis and DNA virus induced silencing. Nucleic Acids Res 34 (21): 6233–46. PMC 1669714. PMID 17090584. doi:10.1093/nar/gkl886.
- Palauqui J, Elmayan T, Pollien J, Vaucheret H (1997). Systemic acquired silencing: transgene-specific post-transcriptional silencing is transmitted by grafting from silenced stocks to non-silenced scions. EMBO J 16 (15): 4738–45. PMC 1170100. PMID 9303318. doi:10.1093/emboj/16.15.4738.
- Lucy A, Guo H, Li W, Ding S (2000). Suppression of post-transcriptional gene silencing by a plant viral protein localized in the nucleus. EMBO J 19 (7): 1672–80. PMC 310235. PMID 10747034. doi:10.1093/emboj/19.7.1672.
- Mérai Z, Kerényi Z, Kertész S, Magna M, Lakatos L, Silhavy D (2006). Double-stranded RNA binding may be a general plant RNA viral strategy to suppress RNA silencing. J Virol 80 (12): 5747–56. PMC 1472586. PMID 16731914. doi:10.1128/JVI.01963-05.
- Katiyar-Agarwal S, Morgan R, Dahlbeck D, Borsani O, Villegas A, Zhu J, Staskawicz B, Jin H (2006). A pathogen-inducible endogenous siRNA in plant immunity. Proc Natl Acad Sci USA 103 (47): 18002–7. PMC 1693862. PMID 17071740. doi:10.1073/pnas.0608258103.
- Fritz J, Girardin S, Philpott D (2006). Innate immune defense through RNA interference. Sci STKE 2006 (339): pe27. PMID 16772641. doi:10.1126/stke.3392006pe27.
- Zambon R, Vakharia V, Wu L (2006). RNAi is an antiviral immune response against a dsRNA virus in Drosophila melanogaster. Cell Microbiol 8 (5): 880–9. PMID 16611236. doi:10.1111/j.1462-5822.2006.00688.x.
- Wang X, Aliyari R, Li W, Li H, Kim K, Carthew R, Atkinson P, Ding S (2006). RNA interference directs innate immunity against viruses in adult Drosophila. Science 312 (5772): 452–4. PMC 1509097. PMID 16556799. doi:10.1126/science.1125694.
- Lu R, Maduro M, Li F, Li H, Broitman-Maduro G, Li W, Ding S (2005). Animal virus replication and RNAi-mediated antiviral silencing in Caenorhabditis elegans. Nature 436 (7053): 1040–3. PMC 1388260. PMID 16107851. doi:10.1038/nature03870.
- Wilkins C, Dishongh R, Moore S, Whitt M, Chow M, Machaca K (2005). RNA interference is an antiviral defence mechanism in Caenorhabditis elegans. Nature 436 (7053): 1044–7. PMID 16107852. doi:10.1038/nature03957.
- Berkhout B, Haasnoot J (2006). The interplay between virus infection and the cellular RNA interference machinery. FEBS Lett 580 (12): 2896–902. PMID 16563388. doi:10.1016/j.febslet.2006.02.070.
- Schütz S, Sarnow P (2006). Interaction of viruses with the mammalian RNA interference pathway. Virology 344 (1): 151–7. PMID 16364746. doi:10.1016/j.virol.2005.09.034.
- Cullen B (2006). Is RNA interference involved in intrinsic antiviral immunity in mammals?. Nat Immunol 7 (6): 563–7. PMID 16715068. doi:10.1038/ni1352.
- Li H, Ding S (2005). Antiviral silencing in animals. FEBS Lett 579 (26): 5965–73. PMC 1350842. PMID 16154568. doi:10.1016/j.febslet.2005.08.034.
- Carrington J, Ambros V (2003). Role of microRNAs in plant and animal development. Science 301 (5631): 336–8. PMID 12869753. doi:10.1126/science.1085242.
- Lee R, Feinbaum R, Ambros V (1993). The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 75 (5): 843–54. PMID 8252621. doi:10.1016/0092-8674(93)90529-Y.
- Palatnik J, Allen E, Wu X, Schommer C, Schwab R, Carrington J, Weigel D (2003). Control of leaf morphogenesis by microRNAs. Nature 425 (6955): 257–63. PMID 12931144. doi:10.1038/nature01958.
- Zhang B, Pan X, Cobb G, Anderson T (2006). Plant microRNA: a small regulatory molecule with big impact. Dev Biol 289 (1): 3–16. PMID 16325172. doi:10.1016/j.ydbio.2005.10.036.
- Jones-Rhoades M, Bartel D, Bartel B (2006). MicroRNAS and their regulatory roles in plants. Annu Rev Plant Biol 57: 19–53. PMID 16669754. doi:10.1146/annurev.arplant.57.032905.105218.
- Zhang B, Pan X, Cobb G, Anderson T (2007). microRNAs as oncogenes and tumor suppressors. Dev Biol 302 (1): 1–12. PMID 16989803. doi:10.1016/j.ydbio.2006.08.028.
- Check E (2007). RNA interference: hitting the on switch. Nature 448 (7156): 855–858. PMID 17713502. doi:10.1038/448855a.
- Li LC, Okino ST, Zhao H, et al. (2006). Small dsRNAs induce transcriptional activation in human cells. Proc. Natl. Acad. Sci. U.S.A. 103 (46): 17337–42. PMC 1859931. PMID 17085592. doi:10.1073/pnas.0607015103.
- Cerutti H, Casas-Mollano J (2006). On the origin and functions of RNA-mediated silencing: from protists to man. Curr Genet 50 (2): 81–99. PMC 2583075. PMID 16691418. doi:10.1007/s00294-006-0078-x.
- Buchon N, Vaury C (2006). RNAi: a defensive RNA-silencing against viruses and transposable elements. Heredity 96 (2): 195–202. PMID 16369574. doi:10.1038/sj.hdy.6800789.
- Obbard D, Jiggins F, Halligan D, Little T (2006). Natural selection drives extremely rapid evolution in antiviral RNAi genes. Curr Biol 16 (6): 580–5. PMID 16546082. doi:10.1016/j.cub.2006.01.065.
- Voorhoeve PM, Agami R (2003). Knockdown stands up. Trends Biotechnol. 21 (1): 2–4. PMID 12480342. doi:10.1016/S0167-7799(02)00002-1.
- Qiu S, Adema C, Lane T (2005). A computational study of off-target effects of RNA interference. Nucleic Acids Res 33 (6): 1834–47. PMC 1072799. PMID 15800213. doi:10.1093/nar/gki324.
- Naito Y, Yamada T, Matsumiya T, Ui-Tei K, Saigo K, Morishita S (2005). dsCheck: highly sensitive off-target search software for double-stranded RNA-mediated RNA interference. Nucleic Acids Res 33 (Web Server issue): W589–91. PMC 1160180. PMID 15980542. doi:10.1093/nar/gki419.
- Henschel A, Buchholz F, Habermann B (2004). DEQOR: a web-based tool for the design and quality control of siRNAs. Nucleic Acids Res 32 (Web Server issue): W113–20. PMC 441546. PMID 15215362. doi:10.1093/nar/gkh408.
- Naito Y, Yamada T, Ui-Tei K, Morishita S, Saigo K (2004). siDirect: highly effective, target-specific siRNA design software for mammalian RNA interference. Nucleic Acids Res 32 (Web Server issue): W124–9. PMC 441580. PMID 15215364. doi:10.1093/nar/gkh442.
- Naito Y, Ui-Tei K, Nishikawa T, Takebe Y, Saigo K (2006). siVirus: web-based antiviral siRNA design software for highly divergent viral sequences. Nucleic Acids Res 34 (Web Server issue): W448–50. PMC 1538817. PMID 16845046. doi:10.1093/nar/gkl214.
- Reynolds A, Anderson E, Vermeulen A, Fedorov Y, Robinson K, Leake D, Karpilow J, Marshall W, Khvorova A (2006). Induction of the interferon response by siRNA is cell type- and duplex length-dependent. RNA 12 (6): 988–93. PMC 1464853. PMID 16611941. doi:10.1261/rna.2340906.
- Stein P, Zeng F, Pan H, Schultz R (2005). Absence of non-specific effects of RNA interference triggered by long double-stranded RNA in mouse oocytes. Dev Biol 286 (2): 464–71. PMID 16154556. doi:10.1016/j.ydbio.2005.08.015.
- Brummelkamp T, Bernards R, Agami R (2002). A system for stable expression of short interfering RNAs in mammalian cells. Science 296 (5567): 550–3. PMID 11910072. doi:10.1126/science.1068999.
- Tiscornia G, Tergaonkar V, Galimi F, Verma I (2004). CRE recombinase-inducible RNA interference mediated by lentiviral vectors. Proc Natl Acad Sci USA 101 (19): 7347–51. PMC 409921. PMID 15123829. doi:10.1073/pnas.0402107101.
- Ventura A, Meissner A, Dillon C, McManus M, Sharp P, Van Parijs L, Jaenisch R, Jacks T (2004). Cre-lox-regulated conditional RNA interference from transgenes. Proc Natl Acad Sci USA 101 (28): 10380–5. PMC 478580. PMID 15240889. doi:10.1073/pnas.0403954101.
- Brock T, Browse J, Watts J (2006). Genetic regulation of unsaturated fatty acid composition in C. elegans. PLoS Genet 2 (7): e108. PMC 1500810. PMID 16839188. doi:10.1371/journal.pgen.0020108. Архів оригіналу за 22 лютого 2008. Процитовано 28 квітня 2019.
- Kamath R, Ahringer J (2003). Genome-wide RNAi screening in Caenorhabditis elegans. Methods 30 (4): 313–21. PMID 12828945. doi:10.1016/S1046-2023(03)00050-1.
- Boutros M, Kiger A, Armknecht S, Kerr K, Hild M, Koch B, Haas S, Paro R, Perrimon N (2004). Genome-wide RNAi analysis of growth and viability in Drosophila cells. Science 303 (5659): 832–5. PMID 14764878. doi:10.1126/science.1091266.
- Fortunato A, Fraser A (2005). Uncover genetic interactions in Caenorhabditis elegans by RNA interference. Biosci Rep 25 (5–6): 299–307. PMID 16307378. doi:10.1007/s10540-005-2892-7.
- Cullen L, Arndt G (2005). Genome-wide screening for gene function using RNAi in mammalian cells. Immunol Cell Biol 83 (3): 217–23. PMID 15877598. doi:10.1111/j.1440-1711.2005.01332.x.
- Huesken D, Lange J, Mickanin C, Weiler J, Asselbergs F, Warner J, Meloon B, Engel S, Rosenberg A, Cohen D, Labow M, Reinhardt M, Natt F, Hall J (2005). Design of a genome-wide siRNA library using an artificial neural network. Nat Biotechnol 23 (8): 995–1001. PMID 16025102. doi:10.1038/nbt1118.
- Janitz M, Vanhecke D, Lehrach H (2006). High-throughput RNA interference in functional genomics. Handb Exp Pharmacol 173 (173): 97–104. PMID 16594612. doi:10.1007/3-540-27262-3_5.
- Vanhecke D, Janitz M (2005). Functional genomics using high-throughput RNA interference. Drug Discov Today 10 (3): 205–12. PMID 15708535. doi:10.1016/S1359-6446(04)03352-5.
- Geldhof P, Murray L, Couthier A, Gilleard J, McLauchlan G, Knox D, Britton C (2006). Testing the efficacy of RNA interference in Haemonchus contortus. Int J Parasitol 36 (7): 801–10. PMID 16469321. doi:10.1016/j.ijpara.2005.12.004.
- Geldhof P, Visser A, Clark D, Saunders G, Britton C, Gilleard J, Berriman M, Knox D. (2007). RNA interference in parasitic helminths: current situation, potential pitfalls and future prospects. Parasitology 134 (Pt 5): 1–11. PMID 17201997. doi:10.1017/S0031182006002071.
- Travella S, Klimm T, Keller B (2006). RNA interference-based gene silencing as an efficient tool for functional genomics in hexaploid bread wheat. Plant Physiol 142 (1): 6–20. PMC 1557595. PMID 16861570. doi:10.1104/pp.106.084517.
- McGinnis K, Chandler V, Cone K, Kaeppler H, Kaeppler S, Kerschen A, Pikaard C, Richards E, Sidorenko L, Smith T, Springer N, Wulan T (2005). Transgene-induced RNA interference as a tool for plant functional genomics. Methods Enzymol 392: 1–24. PMID 15644172. doi:10.1016/S0076-6879(04)92001-0.
- Paddison P, Caudy A, Hannon G (2002). Stable suppression of gene expression by RNAi in mammalian cells. Proc Natl Acad Sci USA 99 (3): 1443–8. PMC 122210. PMID 11818553. doi:10.1073/pnas.032652399.
- Sah D (2006). Therapeutic potential of RNA interference for neurological disorders. Life Sci 79 (19): 1773–80. PMID 16815477. doi:10.1016/j.lfs.2006.06.011.
- Zender L, Hutker S, Liedtke C, Tillmann H, Zender S, Mundt B, Waltemathe M, Gosling T, Flemming P, Malek N, Trautwein C, Manns M, Kuhnel F, Kubicka S (2003). Caspase 8 small interfering RNA prevents acute liver failure in mice. Proc Natl Acad Sci USA 100 (13): 7797–802. PMC 164667. PMID 12810955. doi:10.1073/pnas.1330920100.
- Jiang M, Milner J (2002). Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference. Oncogene 21 (39): 6041–8. PMID 12203116. doi:10.1038/sj.onc.1205878.
- Crowe S (2003). Suppression of chemokine receptor expression by RNA interference allows for inhibition of HIV-1 replication, by Martínez et al.. AIDS. 17 Suppl 4: S103–5. PMID 15080188.
- Kusov Y, Kanda T, Palmenberg A, Sgro J, Gauss-Müller V (2006). Silencing of hepatitis A virus infection by small interfering RNAs. J Virol 80 (11): 5599–610. PMC 1472172. PMID 16699041. doi:10.1128/JVI.01773-05.
- Jia F, Zhang Y, Liu C (2006). A retrovirus-based system to stably silence hepatitis B virus genes by RNA interference. Biotechnol Lett 28 (20): 1679–85. PMID 16900331. doi:10.1007/s10529-006-9138-z.
- Hu L, Wang Z, Hu C, Liu X, Yao L, Li W, Qi Y (2005). Inhibition of Measles virus multiplication in cell culture by RNA interference. Acta Virol 49 (4): 227–34. PMID 16402679.
- Raoul C, Barker S, Aebischer P (2006). Viral-based modelling and correction of neurodegenerative diseases by RNA interference. Gene Ther 13 (6): 487–95. PMID 16319945. doi:10.1038/sj.gt.3302690.
- Putral L, Gu W, McMillan N (2006). RNA interference for the treatment of cancer. Drug News Perspect 19 (6): 317–24. PMID 16971967. doi:10.1358/dnp.2006.19.6.985937.
- Izquierdo M (2005). Short interfering RNAs as a tool for cancer gene therapy. Cancer Gene Ther 12 (3): 217–27. PMID 15550938. doi:10.1038/sj.cgt.7700791.
- Li C, Parker A, Menocal E, Xiang S, Borodyansky L, Fruehauf J (2006). Delivery of RNA interference. Cell Cycle 5 (18): 2103–9. PMID 16940756. doi:10.4161/cc.5.18.3192.
- Takeshita F, Ochiya T (2006). Therapeutic potential of RNA interference against cancer. Cancer Sci 97 (8): 689–96. PMID 16863503. doi:10.1111/j.1349-7006.2006.00234.x.
- Berkhout, B; ter Brake, O (2010). RNAi Gene Therapy to Control HIV-1 Infection. RNA Interference and Viruses: Current Innovations and Future Trends. Caister Academic Press. ISBN 978-1-904455-56-1.
- Tong A, Zhang Y, Nemunaitis J (2005). Small interfering RNA for experimental cancer therapy. Curr Opin Mol Ther 7 (2): 114–24. PMID 15844618.
- Grimm D, Streetz K, Jopling C, Storm T, Pandey K, Davis C, Marion P, Salazar F, Kay M (2006). Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways. Nature 441 (7092): 537–41. PMID 16724069. doi:10.1038/nature04791.
- Ledford, Heidi (2018). Gene-silencing technology gets first drug approval after 20-year wait. Nature. ISSN 0028-0836. doi:10.1038/d41586-018-05867-7.(англ.)
- Sunilkumar G, Campbell L, Puckhaber L, Stipanovic R, Rathore K (2006). Engineering cottonseed for use in human nutrition by tissue-specific reduction of toxic gossypol. Proc Natl Acad Sci USA 103 (48): 18054–9. PMC 1838705. PMID 17110445. doi:10.1073/pnas.0605389103.
- Siritunga D, Sayre R (2003). Generation of cyanogen-free transgenic cassava. Planta 217 (3): 367–73. PMID 14520563. doi:10.1007/s00425-003-1005-8.
- Le L, Lorenz Y, Scheurer S, Fötisch K, Enrique E, Bartra J, Biemelt S, Vieths S, Sonnewald U (2006). Design of tomato fruits with reduced allergenicity by dsRNAi-mediated inhibition of ns-LTP (Lyc e 3) expression. Plant Biotechnol J 4 (2): 231–42. PMID 17177799. doi:10.1111/j.1467-7652.2005.00175.x.
- Gavilano L, Coleman N, Burnley L, Bowman M, Kalengamaliro N, Hayes A, Bush L, Siminszky B (2006). Genetic engineering of Nicotiana tabacum for reduced nornicotine content. J Agric Food Chem 54 (24): 9071–8. PMID 17117792. doi:10.1021/jf0610458.
- Allen R, Millgate A, Chitty J, Thisleton J, Miller J, Fist A, Gerlach W, Larkin P (2004). RNAi-mediated replacement of morphine with the nonnarcotic alkaloid reticuline in opium poppy. Nat Biotechnol 22 (12): 1559–66. PMID 15543134. doi:10.1038/nbt1033.
- Zadeh A, Foster G (2004). Transgenic resistance to tobacco ringspot virus. Acta Virol 48 (3): 145–52. PMID 15595207.
- Niggeweg R, Michael A, Martin C (2004). Engineering plants with increased levels of the antioxidant chlorogenic acid. Nat Biotechnol 22 (6): 746–54. PMID 15107863. doi:10.1038/nbt966.
- Sanders R, Hiatt W (2005). Tomato transgene structure and silencing. Nat Biotechnol 23 (3): 287–9. PMID 15765076. doi:10.1038/nbt0305-287b.
- Chiang C, Wang J, Jan F, Yeh S, Gonsalves D (2001). Comparative reactions of recombinant papaya ringspot viruses with chimeric coat protein (CP) genes and wild-type viruses on CP-transgenic papaya. J Gen Virol 82 (Pt 11): 2827–36. PMID 11602796.
Посилання
- Огляд процесу РНК-інтерференції від The Naked Scientists (англ.)
- Анімація процесу РНК-інтерференції із журналу Nature (англ.)
- NOVA scienceNOW про РНК-інтерференцію — 5-хвилинне популярне відео про відкриття РНК-інтерференції (англ.)
- Silencing Genomes Опис експериментів по РНК-інтерференції на C. elegans для навчання. Від центру вивчення ДНК Cold Spring Harbor Laboratory. (англ.)
- 2 American ‘Worm People’ Win Nobel for RNA Work, стаття про Нобелівських лауреатів, що відкрили РНК-інтерференцію, у New York Times (англ.)
- Molecular Therapy web focus: «The development of RNAi as a therapeutic strategy», збірка безкоштовних статей про використання РНК-інтерференції у терапії. (англ.)