Кислотні опади
Кисло́тні опади — це всі види метеорологічних опадів: дощ, сніг, град, туман, дощ зі снігом, кислотність яких вища від нормальної. Мірою кислотності є значення рН (водневий показник). Нормальне pH у чистих дощах — 5,6.
Загальна характеристика
У нове тисячоріччя людство вступає в умовах екологічної кризи. В останній чверті XX століття є три глобальні екологічні проблеми: руйнування озонового шару Землі, що прогресує; потепління її клімату та кислотні дощі — зробили цілком реальною погрозу самознищення людства. Ще наприкінці позаминулого століття Фрідріх Енгельс попереджав: «Не будемо, однак, занадто зваблюватися нашими перемогами над природою. За кожну таку перемогу вона нам мстить. Кожна з цих перемог має, щоправда, у першу чергу ті наслідки, на які ми розраховували, але в другу і третю чергу зовсім інші, непередбачені наслідки, що дуже часто знищують наслідки перших». Знайомство з проблемою кислотних дощів підтвердить нам правоту цих слів.
Для успішного вирішення планетарних екологічних криз і подальшого розвитку людської цивілізації необхідні розуміння й усвідомлення цих кризових проблем, щоб направити свою діяльність на зміну структури суспільного і господарського пристрою, формування екологічного світогляду, .
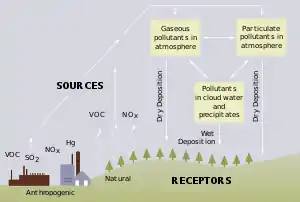
Кислотні опади в кінці ХХ і на початку XXI ст. стали істотними компонентами атмосфери. Вони випадають у країнах Європи, Північної Америки, а також у районах найбільших агломерацій Азії і Латинської Америки. Головна причина кислотних опадів — надходження сполук сірки і азоту в атмосферу при спаленні викопного палива в стаціонарних установках і двигунах транспорту. Кислотні опади завдають шкоди будівлям, пам'ятникам і металевим конструкціям, викликають дигресію і загибель лісів, знижують урожай багатьох сільськогосподарських культур, погіршують родючість ґрунтів, що мають кислу реакцію, і стан водних екосистем.
Показники кислотності різних речовин
Шкала значення рН йде від 0 (украй висока кислотність), через 7 (нейтральне середовище) до 14 (лужне середовище), причому нейтральна точка (чиста вода) має рН = 7. Дощова вода в чистому повітрі має рН = 5,6. Чим нижче значення рН, тим вища кислотність. Якщо кислотність води нижче 5,5, то опади вважаються кислотними.
Варто звернути увагу ще на одну особливість шкали рН. Кожна наступна сходинка на шкалі рН говорить про десятикратну зміну концентрації іонів водню в розчині. Наприклад, кислотність речовини зі значенням рН 4 у десять разів вища від кислотності речовини зі значенням рН 5, у сто разів вища, ніж кислотність речовини зі значенням рН 6 і в сто тисяч разів вища, ніж кислотність речовини зі значенням рН 9.
Для визначення показника кислотності використовують різні рН-метри, зокрема дорогі електронні прилади. Простим способом визначення характеру середовища є застосування індикаторів — хімічних речовин, забарвлення яких змінюється в залежності від рН середовища. Найбільш розповсюджені індикатори — фенолфталеїн, метилоранж, лакмус, а також природні барвники з червоної капусти і чорної смородини.
Основні джерела кислотоутворюючих викидів
- Джерела кислото-створюючих викидів: теплові електростанції, автотранспорт, металургійні і хімічні підприємства, авіація.
Однією з причин кислотних опадів є також тваринництво. Справа у великій кількості відходів, що залишають тварини. У гною міститься аміак, який переробляє бактерії у кислоту, яка, випаровуючись, з'єднується з окисом азоту, що є в добривах, а це сприяє випаданню кислотних дощів.
Об'єкти впливу: люди, тваринний і рослинний світ, водоймища, ґрунт, будівлі, пам'ятки культури, вироби з металу.
Механізм утворення кислотних опадів
Кислотний дощ утворюється в результаті реакції між водою і такими забруднюючими речовинами, як діоксид сірки (SO2) і різних оксидів азоту (NOx). Ці речовини викидаються в атмосферу автомобільним транспортом, у результаті діяльності металургійних підприємств і електростанцій, а також при спалюванні вугілля і деревини. Вступаючи в реакцію з водою атмосфери, вони перетворюються в розчини кислот: сірчаної, сірчистої, азотистої й азотної. Потім, разом із снігом чи дощем, вони випадають на землю.
Природними джерелами надходження діоксиду сірки в атмосферу є головним чином вулкани і лісові пожежі. Тим часом природні надходження в атмосферу оксидів азоту зв'язані головним чином з електричними розрядами, при яких утвориться NO, згодом — NO2. Значна частина оксидів азоту природного походження переробляється в ґрунті мікроорганізмами, тобто включена в біохімічний колообіг.
Джерела викидів в атмосферу оксидів сірки (a) і азоту (б) Схема утворення кислотних аерозолів і дощів
Діоксид сірки, що потрапив в атмосферу, перетерплює ряд хімічних перетворень, що ведуть до утворення кислот. Частково діоксид сірки в результаті фотохімічного окислювання перетворюється в триоксид сірки (сірчаний ангідрид) SO3:
- 2SO2 + О2 → 2SO3,
який реагує з водяною парою атмосфери, утворюючи аерозолі сірчаної кислоти:
- SO3 + Н2О → H2SO4.
Основна частина діоксиду сірки, що викидається у вологому повітрі утворить аерозоль сірчистої кислоти і зображують умовною формулою Н2SO3:
- SO2 + H2O → H2SO3.
Сірчиста кислота у вологому повітрі поступово окислюється до сірчаної:
- 2H2SO3 + O2 → 2H2SO4.
Аерозолі сірчаної і сірчистої кислот приводять до конденсації водяної пари атмосфери і стають причиною кислотних опадів (дощі, тумани, сніг). При спалюванні палива утворяться тверді мікрочастинки сульфатів металів (в основному при спалюванні вугілля), легко розчинні у воді, що осаджуються на ґрунт і рослини, роблячи кислотними роси. Аерозолі сірчаної і сірчистої кислот складають близько 2/3 кислотних опадів, інше приходиться на частку аерозолів азотної й азотистої кислот, що утворяться при взаємодії діоксиду азоту з водяною парою атмосфери:
- 2NO2 + H2О → HNO3 + HNO2
Існують ще два види кислотних дощів, що поки не відслідковуються моніторингом атмосфери. Хлор, що знаходиться в атмосфері, при з'єднанні з метаном (джерела надходження метану в атмосферу: антропогенний — рисові поля, а також результат танення гідрату метану у вічній мерзлоті внаслідок потеплення клімату) утворить хлороводень, що добре розчиняється у воді з утворенням аерозолів соляної кислоти:
- Cl + СН4 → CH3 + HCI, СН3 + Cl2 → СН3Cl + Cl
Шкідливий вплив на екосистеми, пам'ятки і людей
У водяних екосистемах кислотні опади викликають загибель риб та інших водяних мешканців. Підкислення води рік і озер серйозно впливає і на тварин суходолу, тому що багато звірів і птахів входять до складу харчових ланцюгів, що починаються у водяних екосистемах. Разом із загибеллю озер стає очевидною і деградація лісів. Кислоти порушують захисний восковий покрив листя, роблячи рослини уразливішими для комах, грибів і інших патогенних мікроорганізмів. Під час посухи через ушкоджені листи випаровується більше вологи. Вилуджування біогенів із ґрунту і вивільнення токсичних елементів сприяє уповільненню росту і загибелі дерев. Можна припустити, що відбувається і з дикими видами тварин, коли гинуть ліси. Якщо руйнується лісова екосистема, починається ерозія ґрунту, засмічення водоймищ, повінь і погіршення запасів води стають катастрофічними. Підкислення ґрунту азотнокислими дощами стимулює розвиток лісових шкідників. У результаті закислення в ґрунті відбувається розчинення живильних речовин, життєво необхідних рослинам; ці речовини виносяться дощами в ґрунтові води. Одночасно вилуджуються з ґрунту і важкі метали, що потім засвоюються рослинами, викликаючи в них серйозні ушкодження. Використовуючи такі рослини в їжу, людина також одержує разом з ними підвищену дозу важких металів. Коли деградує ґрунтова фауна, знижуються врожаї, погіршується якість сільськогосподарської продукції, а це, як ми знаємо, спричиняє погіршення здоров'я населення. Під дією кислот з гірських порід і мінералів вивільняється алюміній, а також ртуть і свинець, що потім потрапляють у поверхневі і ґрунтові води.
Небезпечний алюміній
Алюміній здатний викликати хворобу Альцгеймера[джерело?], різновид передчасного старіння. Важкі метали, що потрапляють у природні води, негативно впливають на нирки, печінку, центральну нервову систему, викликаючи різні онкологічні захворювання. Генетичні наслідки отруєння важкими металами можуть проявитися через 20 років і більш не тільки в тих, хто вживає брудну воду, але й у їхніх нащадків.
Небезпечні сполуки сірки і сульфатних часток
Забруднення повітря кислотою утворюючими викидами робить різноманітний шкідливий вплив і на організм людини. Вдихання вологого повітря, що містить діоксид сірки, особливо небезпечно для людей похилого віку, що страждають серцево-судинними і легеневими захворюваннями, у важких випадках може виникнути набряк легень[джерело?]. Шкідливо це і для здорових людей, оскільки SO2 і сульфатні частки мають канцерогенну дію[джерело?]. Установлено тісний взаємозв'язок між підвищенням смертності від бронхітів і ростом концентрації діоксиду сірки в повітрі[джерело?]. Під час небезпечного лондонського туману 1952 р. більш 4000 смертей було віднесено за рахунок підвищеного вмісту у вологому повітрі діоксиду сірки і сульфатних часток[джерело?]. Численні дослідження показали збільшення числа захворювань дихальних шляхів у районах, повітря яких забруднений діоксидом азоту NO2[джерело?]. Потрапляючи в дихальні шляхи, він взаємодіє з гемоглобіном крові, утрудняючи перенос кисню до органів і тканин, викликає респіраторні, астматичні і серцеві захворювання. У лютому 1972 р. у Японії з цієї причини занедужало більш 70 000 чоловік, для багатьох з них захворювання мало летальний результат[джерело?].
Пошкодження пам'яток та лісів
Кислотні дощі роз'їдають метали, фарби, синтетичні з'єднання, руйнують архітектурні пам'ятки. Багато скульптур і будинків у Римі, Венеції й інших містах, пам'ятники зодчества, такі, як Парфенон у Афінах, Кельнський собор та інші, за кілька останніх десятиліть одержали значно більші ушкодження, ніж за весь попередній час. Під загрозою повного руйнування в результаті дії кислотних опадів знаходяться більш 50 тис. скульптур скельного «Міста Будд» під Юньанем у Китаї, побудованого 15 століть тому. Найхарактерніші кислотні дощі для індустріальних країн з високорозвиненою енергетикою. Найбільшу втрату вони нанесли лісам Центральної Європи, зокрема 35 % лісів Німеччини (на площі більш 2,5 млн га) ушкоджені ними[джерело?]. Збиток від кислотних дощів для європейських лісів оцінюється в 118 млн м3 деревини в рік (з них близько 35 млн м3 на європейській території Росії)[джерело?]. У меншому ступені від кислотних дощів страждають сільськогосподарські рослини, оскільки підкислення ґрунтів тут можна контролювати агрохімікатами. Для боротьби з кислотними дощами необхідно направити зусилля на скорочення викидів кислотоутворюючих речовин вугільними електростанціями. А для цього необхідно:
- використання низькосірчистого вугілля чи його очищення від сірки;
- установка фільтрів для очищення газоподібних продуктів;
- застосування альтернативних джерел енергії.
Більшість заклопотаних власними проблемами людей і недалекоглядних державних діячів залишається байдужими до проблеми кислотних дощів.
Посилання
- Екологія. В. Т
- Шкода для світу від виробництва м'яса
- Дощ кислотний // Словник-довідник з екології : навч.-метод. посіб. / уклад. О. Г. Лановенко, О. О. Остапішина. — Херсон : ПП Вишемирський В. С., 2013. — С. 72.
- Кислотні опади // Словник-довідник з екології : навч.-метод. посіб. / уклад. О. Г. Лановенко, О. О. Остапішина. — Херсон : ПП Вишемирський В. С., 2013. — С. 105-106.
Література
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.