Фенолфталеїн
Фенолфталеїн (4,4'-діоксифталофенон або 3,3-біс-(4-гідроксифеніл)фталід) — трифенілметановий барвник, кислотно-основний індикатор, що змінює забарвлення від безбарвного (при pH < 8,2) до червоно-фіолетового, «малинового» (в лузі); але в концентрованому лузі — знову безбарвний. У концентрованій сульфатній кислоті утворює помаранчевий катіон.
| Фенолфталеїн | |
|---|---|
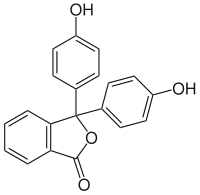 Фенолфталеїн | |
| Ідентифікатори | |
| Номер CAS | 77-09-8 |
| PubChem | 4764 |
| Номер EINECS | 201-004-7 |
| DrugBank | 04824 |
| KEGG | C14286 і D05456 |
| Назва MeSH | D02.455.426.559.389.657.625.555 |
| ChEBI | 34914 |
| Код ATC | A06AB04 |
| SMILES |
C1=CC=C2C(=C1)C(=O)OC2(C3=CC=C(C=C3)O)C4=CC=C(C=C4)O[1] |
| InChI |
InChI=1S/C20H14O4/c21-15-9-5-13(6-10-15)20(14-7-11-16(22)12-8-14)18-4-2-1-3-17(18)19(23)24-20/h1-12,21-22H |
| Властивості | |
| Молекулярна формула | С20H14O4 |
| Молярна маса | 318,32 г/моль |
| Зовнішній вигляд | Білий кристалічний порошок |
| Густина | 1,277 г/см3 |
| Тпл | 258–262 °C |
| Розчинність (вода) | важкорозчинний (порядку 0,018 г/100 г (20 °C)) |
| Розчинність | розчинний у ацетоні (26,4 г/100 г (18°C)) етанолі (26,5 г/100 г (20°C)), піридині (796 г/100 г (20 °C)), метанолі (14,2 г/100 г (18°C)), хлороформі (3,06 г/100 г (18°C)), етилацетаті (6,56 г/100 г (18°C)), бензені (0,16 г/100 г (18°C)) малорозчинний у ксилені, сірковуглеці, тетрахлоретані [2] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Фенолфталеїн є білою кристалічною речовиною без запаху і смаку, погано розчинною у воді, але добре розчинною в етанолі, диетиловому етері та інших органічних розчинниках.
Одержання
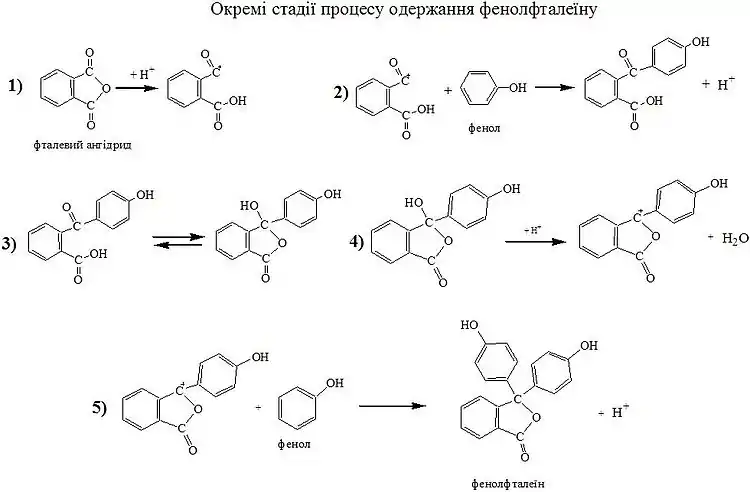
Одержують фенолфталеїн нагріванням суміші фталевого ангідриду і фенолу у мольному співвідношенні 1:2 (фенол часто беруть в надлишку), в присутності концентрованої сульфатної кислоти і цинк хлориду або алюміній хлориду.
Хімічні властивості
Фенолфталеїн є слабкою кислотою (pKa = 9,4 (у воді при 20 °C)).
При сплавленні з кристалічними лугами (наприклад, натрій гідроксидом) перетворюється на 4,4’-дигідроксибензофенон.
При нагріванні з концентрованою сульфатною кислотою розкладається з утворенням фенолу і 2-гідроксиантрахінону.
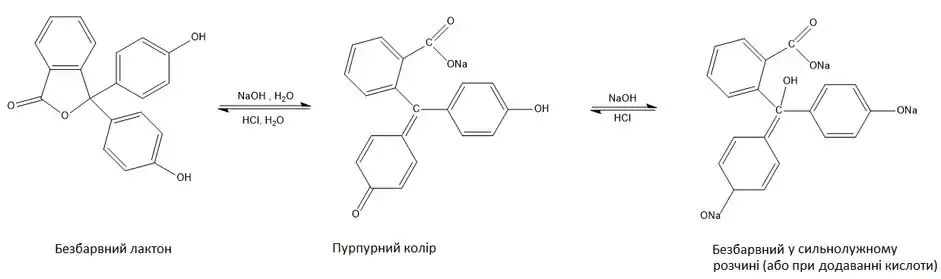
В лужному середовищі відновлюється металевим цинком до безбарвної лейкосполуки. В присутності окисників відбувається зворотній перехід у забарвлену форму, що використовується для якісного виявлення окремих сполук в аналітичній хімії.[3]
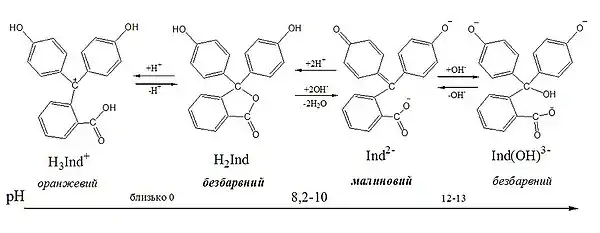
В залежності від рН середовища молекула фенолфталеїну може існувати у розчинах в різних формах, що мають різне забарвлення. Таким чином даний індикатор має одразу декілька інтервалів переходу забарвлення, але в практиці кислотно-основного титрування використовується тільки один з них — в межах 8,2—10. Хіноїдна форма фенолфталеїну, що існує при рН 10—12, має яскраве пурпурне (малинове) забарвлення: максимальне поглинання (λмакс) у видимій частині спектру спостерігається при довжині хвилі 553 нм.
Застосування
Найчастіше застосовується в аналітичній хімії для визначення точки еквівалентності в кислотно-основних методах об'ємного хімічного аналізу. В практиці аналітичної хімії використовується 1%-ний (або 0,1%-ний) його розчин у 60%-му етанолі. Готують 1%-ний розчин шляхом розчинення 1 г фенолфталеїну у 60 см3 етанолу і розведенням дистильованою водою до об'єму 100см3.
Фенолфталеїн використовують для виготовлення змішаних індикаторів (для визначення pH), а також для колориметричного визначення pH розчинів.
Відомий також як фармацевтичний препарат під торговельною маркою «Пурген», що має послаблювальну дію. Але після виявлення певних побічних ефектів, що виявляються у подразненні ниркової тканини і проканцерогенній дії, а також здатності до накопичення в організмі (кумулятивна дія), його використання як лікарського засобу обмежено.
Цікаві факти
- Фенолфталеїн є одним з найбільш відомих кислотно-основних індикаторів і вивчається в межах шкільного курсу хімії. Для запам'ятовування найголовнішого переходу його забарвлення можна використати мнемонічний віршик, що є до певної міри калькою з російськомовного аналогу:
- Фенолфталеїновий у лугах малиновий,
- Лиш в кислоти потрапляє — тут же колір свій втрачає.
- У пацієнтів, що вживаюють фенолфталеїн, сеча може мати рожеве забарвлення.
- Як дієва речовина фенолфталеїн входить до складу кількох лікарських препаратів послаблювальної дії: «Лаксатол», «Лаксоїн», «Феналоін», «Пургіл», а також до складу препарату «Climakterin (Клімактерин)».[4]
- Послаблювальний ефект фенолфталеїну в деяких пацієнтів може проявлятись аж через три доби після вживання.[5]
Примітки
- phenolphthalein
- База данных физико-химических свойств и синтезов веществ
- Индикаторы. : пер. с англ. / Е. Ранке-Мадсен, Е. Бишоп, Е. Баньяи ; ред. Е. Бишоп ; пер. И. Н. Матвеева ; ред. пер. И. Н. Маров. — М. : Мир, 1976. — Т. 1. — 496 с.
- База данных лекарственных средств. Архів оригіналу за 7 квітня 2013. Процитовано 27 червня 2013.
- Современные лекарственные средства. Архів оригіналу за 4 березня 2016. Процитовано 30 липня 2019.
Джерела
- Индикаторы. : пер. с англ. / Е. Ранке-Мадсен, Е. Бишоп, Е. Баньяи ; ред. Е. Бишоп ; пер. И. Н. Матвеева ; ред. пер. И. Н. Маров. — М. : Мир, 1976. — Т. 1. — 496 с. (рос.) (С.?)
- Гринвуд Н. Химия элементов: в 2 томах / Н. Гринвуд, А. Эрншо; пер. с англ. В. А. Михайлова [и др.]. — Москва: Бином. Лаб. знаний, 2008. — Т. 2. — 2008. — 670 с. — ISBN ISBN 978-5-94774-374-6 (рос.) (С.?)
- Кольтгоф И. М. Объёмный анализ в 3т. / Кольтгоф И. М., Стенгер В. А. — М. : Просвещение, 1952. Т. 2. — 445 с. (рос.) (С.?)
- Лурье Ю. Ю. Справочник по аналитической химии. — М.: Издательство иностранной литературы, 1963.- 921 с.(рос.) (С.?)
- Химия: большой энцикл. словарь / Гл. ред. И. Л. Кнунянц. — 2-е изд. — М. : Большая Рос. энцикл., 1998. — 792 с.(рос.) (С.?)
- Химическая энциклопедия: В 5 т. / Редкол.: И. Л. Кнунянц (гл. ред.) и др. — М. : Большая Рос. энцикл., 1998. — Т. 5. — 783 с.(рос.) (С.?)
Література
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.?)
Посилання
- Фенолфталеїн // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
- Современные лекарственные средства
- База данных физико-химических свойств и синтезов веществ
- База данных лекарственных средств
- Solubility table Solubility table(англ.)
