Синдром Гієна — Барре
Синдро́м Гіє́на — Барре́[1] (англ. Guillain-Barré syndrome; СГБ, гостра полірадикулонейропатія) — гостра автоімунна запальна полірадикулонейропатія, яка проявляється млявими парезами і паралічами, порушеннями чутливості, вегетативними розладами. Оскільки на сьогодні поліомієліт є майже усуненим у більшості країн світу, то синдром Гієна — Барре залишається найчастішою причиною гострого млявого паралічу і є однією з серйозних надзвичайних ситуацій у неврології. Також синдром Гієна — Барре можна описати як сукупність клінічних синдромів, що включають гостру запальну полірадикулонейропатію з наявністю слабкості й уповільнення рефлексів.
| Синдром Гієна — Барре | |
|---|---|
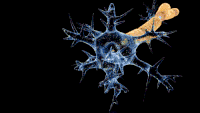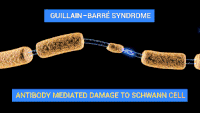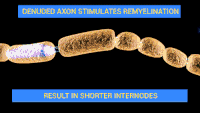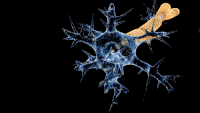 Схема ураження нервів при синдромі Гієна — Барре. Схема ураження нервів при синдромі Гієна — Барре. | |
| Спеціальність | неврологія |
| Симптоми | ascending paralysisd |
| Класифікація та зовнішні ресурси | |
| МКХ-10 | G61.0 |
| OMIM | 139393 |
| DiseasesDB | 5465 |
| MedlinePlus | 000684 |
| eMedicine | neuro/598 |
| MeSH | D020275 |
| | |
Історія вивчення

У 1916 році Жорж Шарль Гієн, Жан Александр Барре і А. Штроль описали особливу форму первинного полірадикулоневріту у 2-х солдатів французької армії. Захворювання мало характерну картину: парези кінцівок, згасання сухожилкових рефлексів, парестезії (відчуття повзання мурашок по тілу), легкі розлади чутливості й білково-клітинна дисоціація в спинномозковій рідині (значне підвищення вмісту білка при нормальному цитозі — клітинному складі). Менш ніж через 2 місяці настало одужання[2]. Це захворювання згодом отримало назву «синдром Гієна — Барре» (прізвище третього автора А. Штроля у багатьох джерелах несправедливо виключили). Автори вважали, що ця хвороба має сприятливий прогноз. Однак, як з'ясувалося пізніше, при цьому синдромі можлива смерть через розвиток висхідного паралічу й дихальної недостатності. Поширена помилка, що синдром Гієна—Барре має хороший прогноз — майже 20 % пацієнтів залишаються тяжкими інвалідами і приблизно 5 % помирають[3]. Проте майже 80 % хворих не тільки справляються з хворобою, але й повністю відновлюють втрачені функції м'язів та інших органів. Зазвичай синдром Гієна — Барре розвивається протягом місяця, після чого настає стабілізація і поліпшення.
Синдром Ландрі
У зв'язку з цим обговорювали схожість картини синдрому Гієна—Барре й ураження, яке спостерігав Ж. Б. Ландрі ще в 1859 році в 10 хворих: висхідні паралічі, включаючи м'язи обличчя і язика, при незначних розладах чутливості. Тяжка симптоматика швидко наростала, двоє хворих загинули[4]. Надалі захворювання було визначено як «висхідний параліч Ландрі». Надалі було зроблено висновок, що ці хвороби — різні за тяжкістю перебігу, є варіантами одного і того ж процесу. Багато авторів пропонували об'єднати їх під загальною назвою: «синдром Ландрі—Гієна—Барре—Штроля».
Синдром Міллера Фішера
У 1956 році також з'явилася інформація, що синдром Міллера Фішера, який характеризується офтальмоплегією, атаксією і арефлексією при розвитку неповного варіанту, і поряд з вищезгаданими проявами порушення свідомості при розвитку повного варіанту (так званий стовбуровий енцефаліт Бікерстаффа), є ймовірним варіантом синдрому Гієна — Барре, тому що за результатами дослідження спинномозкової рідини уражених пацієнтів було виявлено характерну для синдрому Гієна — Барре білково-клітинну дисоціацію[5]. Крім того, клінічні прояви синдрому Гієна — Барре відзначені й у деяких пацієнтів із синдромом Міллера Фішера[6].
Актуальність
У наступні роки при вивченні синдрому Гієна — Барре виникли два напрями. Одне з них характеризується описом нових симптомів і як наслідок цього запереченням самостійності захворювання, інше, навпаки, — виділенням синдрому Гієна — Барре з великої групи полінейропатій в окрему форму. За сучасними уявленнями неврологів терміни «синдром Гієна — Барре», «синдром Ландрі», «синдром Ландрі—Гієна—Барре—Штроля», «гострий первинний полірадикулоневрит», «гостра запальна демієлінізуюча полінейропатія», «гостра постінфекційна полінейропатія», по суті означають одне і те ж захворювання.
Цей синдром у світі виявляють у межах 0,89—1,89 (медіана 1,11) випадків на 100 000 населення, однаково часто в різних регіонах, хоча збільшення на 20 % відбувається на кожні 10 років від першої декади життя. Співвідношення чоловіків до жінок з синдромом 1,78 (95 % довірчий інтервал, від 1,36—2,33). Синдром становить приблизно 20 % усіх полінейропатій.
Причини виникнення синдрому Гієна — Барре
Точні причини синдрому Гієна—Барре досі залишаються недостатньо з'ясованими. Часто він розвивається після гострої інфекційної хвороби. Найбільш часто виявленим патогеном, який чітко пов'язують з подальшим розвитком синдрому Гієна — Барре, є Campylobacter jejuni, збудник кампілобактеріозу. Захворюваність на синдром Гієна — Барре, за оцінками, становить від 0,25 до 0,65 на 1 000 випадків кампілобактеріозу. Тоді як цитомегаловірус ідентифікували в 10 % випадків синдрому Гієна — Барре, що становить від 0,6 до 2,2 на 1 000 випадків первинної цитомегаловірусної інфекції. Інші інфекційні агенти з чітко визначеним зв'язком з виникненням синдрому Гієна — Барре — це вірус Епштейна — Барр, рідко — вірус вітряної віспи та оперізуючого лишаю, Mycoplasma pneumoniae — збудник респіраторного мікоплазмозу, пневмонії тощо. У 1976 році під час масової імунізації проти вірусу грипу А / Нью-Джерсі / +1976 / H1N1 у США люди, які отримали цю вакцину, мали підвищений ризик розвитку синдрому Гієна — Барре[7]. З того часу використання інших сезонних протигрипозних вакцин не продемонструвало збільшення ризику розвитку синдрому. З початком пандемії грипу A (H1N1) в 2009 році існувало велике побоювання, що вакцинація проти цього грипу може також спричинити синдром Гієна — Барре, але цього врешті-решт не сталося[8]. У 2015—2016 роках спалах хвороби, яку спричинює вірус Зіка, що охопив багато країн світу, показав, що клінічний перебіг цього захворювання досить часто ускладнює синдром Гієна — Барре[9]. Отримано підтвердження, що SARS-CoV-2, збудник коронавірусної хвороби 2019, може провокувати розвиток синдрому Гієна — Барре[10] Основною причиною розвитку синдрому Міллера Фішера вважають бактерію Haemophilus influenzae, збудника гемофільної інфекції.
Побічні ефекти від вакцини Janssen
Інформаційною маніпуляцією є дані про те, що «у липні 2021 року було повідомлено про 100 випадків синдрому в США, як побічний ефект від вакцини Janssen»(Ad26.COV2.S)[11] — достовірних джерел, що вказують на будь-яку кількість тих, у кого появився синдром Синдром Гієна — Барре як ускладнення після вакцинації (вакциною Janssen) станом на серпень 2021 немає (ні у США, ні у інших країнах де було її застосовано)[12].
Патогенез
Загальні причини ураження
Через збій у роботі імунної системи «свій — чужий» виникає «молекулярна мімікрія», в результаті чого найбільше страждають периферичні нерви та їхні корінці. Існує достатньо доказів, що підтверджують автоімунну причину цього синдрому, вважають, що в основі хвороби лежать автоімунні механізми, коли імунна система людини починає виробляти антитіла до деяких молекул нервових оболонок, уражаючи таким чином як самі нерви, так і їхні корінці, розташовані на стику периферичної і центральної нервових систем. Спинний і головний мозок при синдромі не ушкоджені.
Патоморфологічні підтипи ураження при синдромі Гієна — Барре
Згідно з гістологічними змінами при синдромі Гієна — Барре розрізняють два підтипи патоморфологічного ураження нервів:
- гостра запальна демієлінізуюча полінейропатія;
- гостра нейропатія моторних аксонів.
Зараження цитомегаловірусом або вірусом Епштейна — Барр асоціюють з гострою запальною демієлінізуючою полінейропатією при синдромі Гієна — Барре, в той час як кампілобактеріоз пов'язують з гострою нейропатією моторних аксонів при синдромі Гієна — Барре і при синдромі Міллера Фішера.
Існують географічні особливості переважання того чи іншого підтипу ураження при синдромі Гієна — Барре — в Європі та Північній Америці абсолютно переважають (до 90 %) випадки з розвитком гострої запальної демієлінізуючої полінейропатії, тоді як у Китаї, Японії, Бангладеш і Мексиці, частота розвитку гострої нейропатії моторних аксонів коливається від 30 до 65 % випадків, а частота розвитку гострої запальної демієлінізуючої полінейропатії таким чином менша.
Вважають, що гостра нейропатія моторних аксонів у деяких випадках може супроводжуватися і ураженнями чутливих нервів. Також припускають, що гостра нейропатія моторних аксонів не призводить до дегенерації останніх. Існують локальні форми синдрому Гієна — Барре, що відрізняються від поширених залученням тільки певних груп м'язів або нервів. Лицева диплегія з парестезіями — є локальною формою гострої запальної демієлінізуючої полінейропатії, в той час як глотково-шийно-плечова слабкість, яка характеризується гострим ураженням ротоглотки, шиї і м'язів плечового поясу, є локальною формою гострої нейропатії моторних аксонів.
Класичними патоморфологічними змінами при гострій запальній демієлінізуючій полінейропатії є запальні інфільтрати, які складають в основному Т-клітини і макрофаги, та ділянки сегментарної демієлінізації, що часто пов'язані з ознаками вторинної дегенерації аксонів, які можна виявити в спинномозкових корінцях, а також у великих і малих рухових та чутливих нервах. Існує свідоцтво ранньої активації комплементу, що ґрунтується на зв'язуванні антитіл з зовнішньою поверхнею клітин Шванна і осадженні активованих компонентів комплементу. Деякі компоненти комплементу, мабуть, ініціюють утворення везикул у мієліні. Вторгнення макрофагів спостерігають протягом 1 тижня після виникнення комплемент-опосередкованого пошкодження мієліну.
При гострій нейропатії моторних аксонів IgG і активований комплемент зв'язуються з аксолемою рухових волокон у вузлах Ранв'є з подальшим утворенням мембраноатакуючого комплексу. Атакований вузол демонструє ознаки дегенерації аксонів рухових волокон, але без лімфоцитарного запалення та демієлінізації. Патоморфологічні дослідження свідчать, що ознаки синдрому Міллера Фішера схожі з проявами синдрому Гієна — Барре. Це передбачає, що використані імуногістохімічні та електронно-мікроскопічні дослідження не здатні точно диференціювати ступінь демієлінізації при гострій нейропатії моторних аксонів як підтипу синдрому Гієна — Барре. Патоморфологічні особливості «чистого» синдрому Міллера Фішера залишаються невизначеними, адже майже усі пацієнти в кінцевому підсумку повністю одужують і смерть вкрай рідка.
Патофізіологічна характеристика уражень
Гангліозиди, які складаються з цераміду, прикріпленого до одного або декількох гексоз, і містять сіалову кислоту (N-ацетілнейрамінову кислоту), пов'язану з серцевиною олігосахаридів, є важливими компонентами периферичних нервів. Чотири гангліозиди — GM1, GD1a, GT1a і GQ1b розрізняють за кількістю і положенням їхніх сіалових кислот. Автоантитіла IgG до GM1 і GD1a пов'язані з гострою нейропатією моторних аксонів, але не з гострою запальною демієлінізуючою полінейропатією. Автоантитіла класу IgG до GQ1b, які перехресно реагують з GT1a, тісно пов'язані з повним і неповним варіантами синдрому Міллера Фішера. Пацієнти з глотково-шийно-плечовою слабкістю, швидше за все, мають анти-GT1a IgG антитіла, які можуть перехресно реагувати з GQ1b. Вони також, що менш імовірно, будуть мати анти-GD1a IgG антитіла, що передбачає зв'язок з гострою нейропатією моторних аксонів Гієна — Барре. Розподіл гангліозідних антигенів пов'язаний з різною клінічною локалізацією уражень при повному синдромі Міллера Фішера. GQ1b явно присутній при ураженні окорухового, блокового і відвідного нервів, а також м'язових нервових сплетень у кінцівках. При ураженні язико-глоткового і блукаючого нервів виявляють значну присутність GT1a і GQ1b, що можливо пов'язане з дисфагією (порушенням ковтання). Деякі дані підтверджують наявність молекулярної мімікрії між ганглиозидами та інфекційними агентами у хворих з синдромом Гієна — Барре і з синдромом Міллера Фішера. Ліпополісахариди є основним компонентом зовнішньої мембрани Campylobacter jejuni. Дослідження показали, що бактеріальні ізоляти (штами) від пацієнтів з синдром Гієна — Барре мають GM1- або GD1a-подібні ліпополісахариди. А ті ліпополісахариди, що виділені у складі бактеріальних збудників від пацієнтів з синдромом Міллера Фішера, імітують GQ1b.
Моделювання синдрому Гієна — Барре на тваринах
Хоча проведено багато експериментальних досліджень на тваринах, які покликані розкрити всі ланки патогенезу синдрому Гієна — Барре, однак на сьогодні визнано, що така модель не є повністю адекватною.
Клінічні прояви
Початковий період
Першими ознаками синдрому Гієна — Барре є оніміння, парестезії, слабкість, біль у кінцівках, або певна комбінація цих симптомів. Основним симптомом вважають м'язову слабкість у кінцівках, і головною особливістю її є наявність двостороннього і симетричного ураження кінцівок. Слабкість прогресує у межах від 12 годин до 28 днів, перш ніж розпал цього синдрому буде досягнуто. Пацієнти зазвичай мають загальну гіпорефлексію або арефлексію. У двох третинах випадків появі м'язової слабкості передують прояви запального ураження верхніх дихальних шляхів, як при ГРВІ, або діареї тривалістю від 3-х днів до 6-ти тижнів. Також для хвороби характерні вегетативні порушення, слабкість лицьових м'язів і ураження інших черепних нервів. При цьому тяжкі порушення чутливості спостерігають не часто. Наявність дистальних парестезій теж вважають характерним для цього синдрому. При залученні у патологічний процес черепних нервів типовими ознаками є провисання половини обличчя, диплопія, дизартрія, дисфагія, параліч зору (офтальмоплегія), звуження зіниць.
Етап прогресування
У більшості пацієнтів, синдром Гієна — Барре продовжує прогресувати у межах від 1 до 3 тижнів від початку хвороби. Дві третини пацієнтів не можуть самостійно ходити, коли слабкість досягає свого максимуму. Гостра дихальна недостатність виникає у 25 % пацієнтів. У таких хворих проводять штучну вентиляцію легенів і в 60 % їх виникає пневмонія, сепсис, легенева емболія, шлунково-кишкова кровотеча. Серед пацієнтів з тяжким перебігом синдрому Гієна — Барре 20 % будуть у змозі ходити лише через 6 місяців після появи симптомів. Спрогнозувати швидкість відновлення при синдромі Гієна — Барре на сьогодні достеменно неможливе, але запропоновані клінічні системи підрахунку очок на підґрунті віку пацієнта, наявності або відсутності попередньої діареї, ступеня тяжкості захворювання, щоб передбачити, чи пацієнт зможе самостійно ходити через 1, 3 або 6 місяців від початку синдрому[13]. Інша прогностична шкала використовує кількість днів між початком м'язової слабкості та госпіталізації, наявність або відсутність ураження лицевого нерву чи бульбарного паралічу, ступеня тяжкості слабкості кінцівок як предиктори ймовірності того, чи зможе розвинутися гостра дихальна недостатність[14].
Синдром Гієна — Барре в цілому перебігає без рецидивів, які фіксували лише в 7 % пацієнтів. Середній інтервал між рецидивами у цих хворих досягає 7 років. Хоча гіпорефлексія або арефлексія є відмінною рисою синдрому Гієна — Барре, проте 10 % хворих мають нормальні або жваві сухожилкові рефлекси в ході хвороби. Таким чином, можливість синдрому Гієна — Барре не слід виключати у пацієнта з нормальними або жвавими сухожилковими рефлексами, якщо всі інші прояви відповідають синдрому.
Прогноз і наслідки
Навіть у країнах розвиненої медицини близько 5 % пацієнтів з синдромом Гієна — Барре помирають від ускладнень, як-от сепсис, тромбоемболія легеневої артерії, раптової незрозумілої зупинки серця, можливо пов'язаної з порушенням вегетативної інервації. Серйозні і потенційно смертельні вегетативні дисфункції, як-от аритмія і серйозна гіпертензія чи гіпотензія, спостерігають у 20 % хворих з синдромом Гієна — Барре.
Діагностика
Ведучим напрямком є клінічна діагностика, яка ґрунтується на появі характерних симптомів, послідовності їх розгортання тощо.
Інструментальна діагностика
Застосовують у непевних ситуаціях магнітно-резонансну томографію (МРТ) спинного мозку аби виключити можливість компресійного його ураження. Проводять дослідження нервово-провідникової провідності, щоб підтвердити наявність і тяжкість невропатії. Ці дослідження мають важливе значення для класифікації ураження, але не є обов'язковими, зважуючи на неможливість їх використання в умовах обмеженості ресурсів медицини у більшості слабкорозвинених країн. Після встановлення діагнозу гострої периферичної нейропатії зрозуміло, що синдром Гієна — Барре є ймовірним діагнозом у більшості пацієнтів. Проте доцільно розглянути можливість альтернативних причин ураження, зокрема васкуліту, авітамінозів, порфірії, токсичної невропатії, хвороби Лайма, дифтерії.
Дослідження спинномозкового ліквора
У більшості (але не у всіх) пацієнтів є підвищення у спинномозковій рідині рівню білка > 400 мг/л з нормальними показниками цитозу (кількості клітин) — до 10 в 1 мкл, усі представлені лімфоцитами. Збільшення рівня білка при збереженні кількості клітин у спинномозковій рідині означає наявність характерної для цього синдрому білково-клітинної дисоціації. Підвищені рівні білка в усіх отриманих порціях спинномозкової рідини при проведенні серійних поперекових пункцій (проколів) при нормальному цитозі є дуже характерними для синдрому Гієна — Барре.
Діагностика при проведенні пробного лікування
Також іноді в діагностиці враховують результати пробного лікування — якщо після нього відбулось клінічне погіршення після початкового поліпшення або періоду стабілізації симптомів, то роблять висновок, що у хворого має місце хронічна запальна демієлінізуюча полінейропатія.
Діагностика хвороб, які спричинюють синдром Гієна — Барре
Здійснюється по тих напрямках, що використовують при діагностиці цих хвороб.
Детальніші відомості з цієї теми ви можете знайти в статті Кампілобактеріоз.
Детальніші відомості з цієї теми ви можете знайти в статті Цитомегаловірусна інфекція.
Детальніші відомості з цієї теми ви можете знайти в статті Хвороба, яку спричинює вірус Зіка.
Детальніші відомості з цієї теми ви можете знайти в статті Гемофільна інфекція.
Лікування
Загальні заходи
Усі пацієнти повинні бути госпіталізовані та залишатися під наглядом у стаціонарі, поки не буде встановлено, що немає ніяких доказів клінічної прогресії. Пацієнти із загрозливим перебігом мають бути госпіталізовані у відділення реанімації, щоб забезпечити безперервний моніторинг функціонального стану їх серцевої і дихальної систем. Пацієнтів з легким перебігом можна лікувати не в реанімаційному відділенні — у блоках інтенсивної терапії, невідкладної неврології.
Навіть за відсутності клінічного виразного респіраторного дистрес-синдрому дорослих, штучна вентиляція легень (ШВЛ) може знадобитися у окремих пацієнтів щонайменше з одним з основних критеріїв або з наявністю двох малих критеріїв. Основними критеріями є гіперкапнія (парціальний тиск артеріальної вуглекислоти > 48 мм рт. ст.), гіпоксемія (парціальний тиск кисню в артеріальній крові, коли пацієнт вдихає навколишнє повітря, < 56 мм рт. ст.), і життєва ємність легень менше 15 мл на кілограм ваги тіла, а малі критерії — непродуктивний кашель, порушення ковтання, ателектаз легені. Потрібно оцінити функцію ковтання — якщо воно значно порушене і потенційно можлива аспірація, то слід поставити з обережністю назогастральний зонд задля проведення відповідного харчування хворого. Тяжка брадикардія може передувати значним коливанням (більше 85 мм рт. ст.) систолічного артеріального тиску. Брадикардію, яка спричинює асистолію, слід попереджувати за допомогою підключення тимчасового водія серцевого ритму.
При лікуванні хворого на синдром Гієна — Барре слід проводити профілактику тромбозу глибоких вен, яку здійснюють за допомогою введення підшкірно гепарину і використання компресійних панчіх. Інші можливі ускладнення включають затримку сечі та запори, їх нівелюють за допомогою катетеризації сечового міхура і застосування проносних засобів відповідно.
Біль у різних місцях передує появі м'язової слабкості у однієї третини пацієнтів з синдромом Гієна — Барре: дві третини їх відчувають біль під час гострої фази перебігу і одна третина — протягом року по тому. Раннє виявлення та лікування цього є важливим. Застосовують опіоїди, габапентин і карбамазепін, в той час як виявлено, що глюкокортикоїди у цій ситуації не є ефективними. Сильна м'язова втома навіть після слабкого фізичного навантаження зберігається у 60 % пацієнтів, що потребує проведення активної фізіотерапії, аеробіки.
Плазмаферез і введення внутрішньовенного імуноглобуліну
Плазмаферез[15], є тим способом лікування, якій достовірно визнано ефективним у прискоренні відновлення пацієнтів з синдромом Гієна — Барре. Його ефективність чітко пов'язана з терміном початку — якщо плазмаферез проведено протягом перших 2 тижнів після початку захворювання, то висока ймовірність видужання. Електрофізіологічне дослідження не завжди потрібно для вирішення питання про початок такого екстракорпорального лікування. Плазмаферез видаляє з плазми циркулюючі імунні комплекси, антитіла, що веде до зменшення пошкодження нерва і швидшого клінічного покращення в порівнянні з тільки підтримуючою терапією. Зазвичай проводять п'ять сеансів плазмаферезу протягом 2-х тижнів, із сумарним видаленням до 5 циркулюючих об'ємів плазми. Введення внутрішньовенного імуноглобуліну протягом 2 тижнів після початку захворювання визнано також ефективним у лікуванні хворих на синдром Гієна — Барре[16]. Вважають, що імуноглобулін може діяти шляхом нейтралізації патогенних антитіл і пригнічення аутоантитіл-опосередкованої активації комплементу, що також призводить до зниження пошкодження нерва і швидшого клінічного поліпшення в порівнянні з відсутністю лікування взагалі[17]. Загалом введення внутрішньовенного імуноглобуліну замінило плазмаферез, як лікувальний метод вибору, в багатьох медичних закладах через його більшу зручність та доступність. Відповідно до стандартного режиму лікування, імуноглобулін призначають у загальній дозі 2 г на кілограм маси тіла протягом 5 днів. Фармакокінетика імуноглобуліну варіює у різних пацієнтів, а також деякі хворі мають менше зростання IgG у сироватці крові після введення імуноглобуліну[18]. Ці пацієнти демонструють найгірший результат такого способу лікування, що ставить питання про необхідність застосування в цій ситуації плазмаферезу. На відміну від роздільного застосування комбінація палазмаферезу та імуноглобуліну не показала статистично достовірного зменшення інвалідізації в подальшому[19][20][21].
Профілактика
Відбуваються заходи, які направлені на запобігання тих хвороб, що є доведеними причинами виникнення синдрому Гієна — Барре. Для профілактики гемофільної інфекції проводять відповідну вакцинацію. Якихось інших загальних можливостей попередити розвиток синдрому Гієна — Барре на сьогодні не існує.
Детальніші відомості з цієї теми ви можете знайти в статті Кампілобактеріоз.
Детальніші відомості з цієї теми ви можете знайти в статті Цитомегаловірусна інфекція.
Детальніші відомості з цієї теми ви можете знайти в статті Хвороба, яку спричинює вірус Зіка.
Детальніші відомості з цієї теми ви можете знайти в статті Гемофільна інфекція.
Цікавий факт
Є припущення, що синдром став причиною смерті Александра Македонського. Його неконтактність і нерухомість перед смертю, тривала нетлінність тіла по смерті пояснюється тим, що через паралічі Александр не міг поворухнутися, а його дихання було вкрай слабким, і він був живим на момент оголошення його померлим і залишався таким певний час по «смерті»[22].
Див. також
Примітки
- Згідно з правилами транскрибування власних імен французькомовного тексту має бути скоріше «Ґійєна — Барре» або «Ґійена — Барре».
- Guillain G, Barré JA, Strohl A. Sur un syndrome de radiculonévrite avec hyperalbuminose du liquide céphalo-rachidien sans réaction cellulaire: remarques sur les caractères cliniques et graphiques des réflexes tendineux. Bulletins et mémoires de la Société des Médecins des Hôpitaux de Paris 1916;40:1462-70.
- Hughes RAC, Swan AV, Raphael JC, Annane D, van Koningsveld R, van Doorn PA. Immunotherapy for Guillain-Barré syndrome: a systematic review. Brain 2007;130:2245-2257
- Jean Baptiste Octave Landry de Thézillat Traité complet des paralysies. T. I. Paris, Masson, 1859.
- Fisher M. An unusual variant of acute idiopathic polyneuritis (syndrome of ophthalmoplegia, ataxia and areflexia). N Engl J Med 1956;255:57-65
- Mori M, Kuwabara S, Fukutake T, Yuki N, Hattori T. Clinical features and prognosis of Miller Fisher syndrome. Neurology 2001;56:1104-1106
- Lehmann HC, Hartung HP, Kieseier BC, Hughes RAC. Guillain-Barré syndrome after exposure to influenza virus. Lancet Infect Dis 2010;10:643-651
- Dieleman J, Romio S, Johansen K, Weibel D, Bonhoeffer J, Sturkenboom M. Guillain-Barré syndrome and adjuvanted pandemic influenza A (H1N1) 2009 vaccine: multinational case-control study in Europe. BMJ 2011;343:d3908-d3908
- WHO. Media centre. Zika virus. Fact sheet. Updated February 2016
- Голубовська О. А. Постковідний синдром: патогенез та основні напрями реабілітації. Медична газета «Здоров'я України 21 сторіччя» № 3 (496), 2021 р.
- На угорських КПП щодня вакцинують до 500 жителів Закарпатської області, mukachevo.net, 13.07.2021
- МАНІПУЛЯЦІЯ: Вакцина від Johnson & Johnson небезпечна через ризик розвитку синдрому Гієна-Барре (9 Серпня 2021)
- van Koningsveld R, Steyerberg EW, Hughes RAC, Swan AV, van Doorn PA, Jacobs BC. A clinical prognostic scoring system for Guillain-Barré syndrome. Lancet Neurol 2007;6:589-594
- Walgaard C, Lingsma HF, Ruts L, et al. Prediction of respiratory insufficiency in Guillain-Barré syndrome. Ann Neurol 2010;67:781-787
- Інструментальне екстракорпоральне видалення плазми крові із поверненням до організму втраченого об'єму за рахунок формених елементів крові та плазмозамінних і сольових розчинів.
- Dalakas MC. Intravenous immunoglobulin in the treatment of autoimmune neuromuscular diseases: present status and practical therapeutic guidelines. Muscle Nerve. 1999 Nov. 22(11):1479-97.
- Jacobs BC, O'Hanlon GM, Bullens RW, Veitch J, Plomp JJ, Willison HJ. Immunoglobulins inhibit pathophysiological effects of anti-GQ1b-positive sera at motor nerve terminals through inhibition of antibody binding. Brain 2003;126:2220-2234
- Kuitwaard K, de Gelder J, Tio-Gillen AP, et al. Pharmacokinetics of intravenous immunoglobulin and outcome in Guillain-Barré syndrome. Ann Neurol 2009;66:597-603
- van der Meche FGA, Schmitz PIM, Dutch Guillain-Barre Study Group. A randomized trial comparing intravenous immune globulin and plasma exchange in Guillain-Barré syndrome. N Engl J Med 1992;326:1123-1129
- Randomised trial of plasma exchange, intravenous immunoglobulin, and combined treatments in Guillain-Barré syndrome. Plasma Exchange/Sandoglobulin Guillain-Barré Syndrome Trial Group. Lancet. 1997 Jan 25. 349(9047):225-30.
- Jayasena YA, Mudalige SP, Manchanayake GS, Dharmapala HL, Kumarasiri RP, Weerasinghe VS, et al. Physiological changes during and outcome following 'filtration' based continuous plasma exchange in Guillain Barre Syndrome. Transfus Apher Sci. 2010 Apr. 42(2):109-13.
- KATHERINE HALL, Did Alexander the Great Die from Guillain-Barré Syndrome? Ancient History Bulletin 2018. Vol 32.3-4. р. 106—128